
| A. | Ca(OH)2溶液 | B. | 浓的CaCl2溶液 | C. | Ba(NO3)2溶液 | D. | H2S的水溶液 |
分析 A.二氧化硫持续通入氢氧化钙溶液先生成亚硫酸钙沉淀,然后亚硫酸钙再与二氧化硫反应生成亚硫酸氢钙;
B.亚硫酸酸性弱于盐酸;
C.二氧化硫通入硝酸钡溶液,二氧化硫被硝酸根离子氧化生成硫酸根离子;
D.二氧化硫与硫化氢发生氧化还原反应生成硫单质和水.
解答 解:A.二氧化硫持续通入氢氧化钙溶液先生成亚硫酸钙沉淀,然后亚硫酸钙再与二氧化硫反应生成亚硫酸氢钙,现象为:先产生沉淀,然后沉淀再消失,故A不选;
B.亚硫酸酸性弱于盐酸,依据强酸制备弱酸规律,二氧化硫与氯化钙溶液不反应,不会产生沉淀,故B选;
C.二氧化硫通入硝酸钡溶液,二氧化硫被硝酸根离子氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,故C不选;
D.二氧化硫与硫化氢发生氧化还原反应生成硫单质和水,硫是不溶于水的物质,所以会产生沉淀,故D不选;
故选:B.
点评 本题考查了元素化合物知识,明确二氧化硫的性质及发生的化学反应是解题关键,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 正反应活化能小于125.4kJ•mol-1 | |
| B. | 逆反应活化能一定小于125.4kJ•mol-1 | |
| C. | 逆反应活化能不小于125.4kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能大125.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 氯化铁溶液滴入沸水 Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 硝酸银溶液中滴入食盐水 NaCl+Ag+═AgCl↓+Na+ | |
| D. | 氯气通入烧碱溶液 Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| B. | 反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| C. | 同温、同浓度的硫酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| D. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 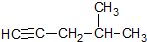 :4-甲基-1-戊炔 :4-甲基-1-戊炔 | B. | CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯 | ||
| C. | 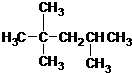 :2,2,4-三甲基戊烷 :2,2,4-三甲基戊烷 | D. |  :间二硝基苯 :间二硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com