
分析 根据Na2CO3和NaHCO3分别与HCl反应的化学方程式即可得出产生CO2的物质的量之比.
解答 解:NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3与HCl反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由以上两个化学方程式可以看出,等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为1:1,则前者等于后者,碳酸钠与盐酸反应的离子方程式为CO32-+2H+=H2O+CO2↑,
故答案为:=;CO32-+2H+=H2O+CO2↑.
点评 本题综合考查了Na2CO3和NaHCO3的性质,侧重于学生的分析能力和元素化合物知识的综合运用的考查,试题内容简单,只要掌握基础知识就可完成.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有CO32- | |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水 | B. | Ba(OH)2•8H2O与NH4Cl(s)混合并搅拌 | ||
| C. | 灼热的炭与CO2反应 | D. | 铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
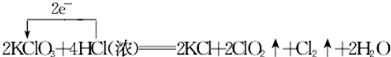 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 步骤 | 现象 |
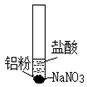 | ⅰ.取少量铝粉于试管,并加入盐酸 | 初始未见明显现象,一段时间后,冒出无色气泡. |
| ⅱ.在试管加入硝酸钠固体 | 继续冒出气泡,液面上方呈浅棕色,试管逐渐变热至沸腾. | |
| ⅲ.用湿润KI-淀粉试纸靠近试管口 | KI-淀粉试纸变蓝色. |
| 装置 | 步骤 | 现象 |
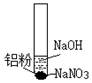 | ⅰ.取少量铝粉于试管,并加入氢氧化钠溶液 | 初始未见明显现象,一段时间后,冒无色气泡. |
| ⅱ.向试管中加入硝酸钠固体 | 继续冒出无色气泡,并有刺激性气味产生 | |
| ⅲ.用湿润红色石蕊试纸靠近试管口 | 试纸变蓝 | |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com