
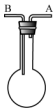
 利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr
利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr分析 (1)若烧瓶是干燥的,若由A进气,则为向下排空气法;则由B口进气A口出气,该收集方法为向上排空气集气法,说明收集气体的密度大于空气,且常温下和空气中氧气不反应;
(2)若烧瓶充满水,可收集的气体应不溶于水,且与水不反应,导气管短进长出;
(3)洗涤气体时,气体应从长导管进,短导管出,且气体与溶液不反应.
解答 解:(1)若由A进气,则为向下排空气法,收集的气体的密度应该比空气的密度小,其不与空气中的氧气反应,所以可收集的气体有:①H2、③NH3,若由B口进气A口出气,此收集方法为向上排空气集气法,说明收集气体的密度大于空气,且常温下和空气中氧气不反应,满足条件的气体有 ②Cl2 、④HCl、⑤HBr,
故答案为:①③;②④⑤;
(2)若烧瓶充满水,可收集的气体应不溶于水,且与水不反应,则①③符合,用排水法收集气体时,气体应从短导管进,即从A进,
故答案为:①③;A;
(3)如果烧瓶内装有一定量的某溶液,用以洗气,气体应从长导管进,短导管出,且气体与溶液不反应,气体应该从B端进入,
故答案为:B.
点评 本题考查了常见气体的收集、干燥方法,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,注意掌握常见气体的性质以及装置的特点和运用.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、Z、W元素的原子半径依次递增 | |
| B. | T元素的非金属性比Z弱 | |
| C. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| D. | Y、Z、W元素在自然界中均不能以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气所含的原子数目为NA | |
| B. | 4 g金属钙变成离子时失去的电子数目为0.1NA | |
| C. | 22.4 L CH4的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4 L CH4和氧气的混合物所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
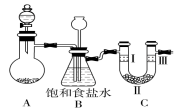 某学习小组围绕氯气设计了一系列实验.
某学习小组围绕氯气设计了一系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1mol氯气发生化学反应,转移的电子数必为2NA | |
| D. | CH4的摩尔质量与NA个CH4分子的质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | C. | Fe2+>I->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com