
| A. | 加入烧碱 | B. | 加入盐酸 | C. | 升高温度 | D. | 加水 |
分析 A.加入NaOH,c(H+)减小;
B.加盐酸,氢离子浓度增大;
C.升高温度促进电离;
D.加水稀释氢离子浓度减小.
解答 解:A.加入烧碱溶液,反应生成CH3COO-,c(H+)减小,使电离平衡右移,故A不选;
B.加盐酸,氢离子浓度增大,但是电离平衡:CH3COOH?CH3COO-+H+左向移动,故B不选;
C.弱电解质的电离为吸热过程,加热促进电离,平衡右移,c(H+)增大,故C选;
D.加水,溶液体积增大,导致氢离子、醋酸浓度都减小,电离平衡:CH3COOH?CH3COO-+H+右向移动,故D不选.
故选C.
点评 本题考查弱电解质的电离,侧重于考查学生的分析能力和化学基本概念的理解和应用能力,为高考常见题型,难度中等,注意把握影响弱电解质的电离的影响因素.


科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 24 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粉状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粉状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
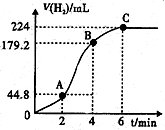
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)═Ca2++2OH- | B. | KNO3═K++NO3- | C. | NH4Cl═4NH++Cl- | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+.Na+.NO3-.H+ | B. | NH4+.Fe3+.SO42-.SCN- | ||
| C. | SO42-.Cl-.Cu2+.Mg2+ | D. | Ba2+.K+.SO32-.H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③⑥ | C. | ①⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙烷和氯气混合光照充分反应,可以制得比较纯净的氯乙烷 | |
| B. | 可以用质谱仪快速、微量、精确地测定它的相对分子质量 | |
| C. | 与其它卤代烃一样,不溶于水,能溶于有机溶剂 | |
| D. | 它在氢氧化钠水溶液中,可以水解发生取代反应,生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com