
| A. | Na+、NH4+、Cl-、CO32- | B. | K+、Ba2+、NO3-、HCO3- | ||
| C. | Na+、K+、SO42-、SiO32- | D. | Na+、Cu2+、Br -、AlO2- |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
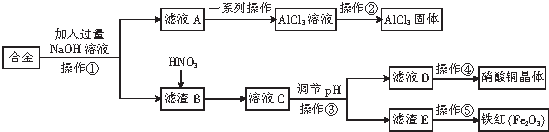
| A. | 滤液A中的溶质主要是NaAlO2和NaOH | |
| B. | 调pH时,可以加入CuO或Cu2(OH)2CO3 | |
| C. | 操作②是在蒸发皿中直接蒸干水分 | |
| D. | 该合金中含有的金属主要为铁、铜、铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
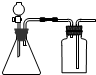
| A. | 将双氧水(H2O2)滴到MnO2中制取O2 | B. | 将浓盐酸滴到浓硫酸中制取HCl | ||
| C. | 将浓氨水滴到生石灰(CaO)中制取NH3 | D. | 将稀硫酸滴到锌粒上中制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
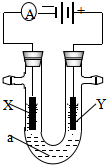 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是一种黄绿色、有刺激性气味、有毒的气体 | |
| B. | Cl2能使湿润的红色布条褪色 | |
| C. | Fe在Cl2中燃烧,生成的产物为FeCl2 | |
| D. | 实验室用加热二氧化锰和浓盐酸的方法制取Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com