
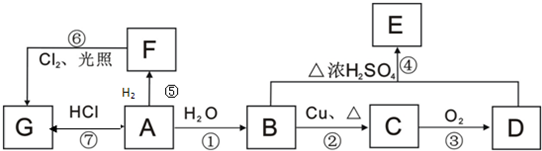
分析 A 常用来衡量一个国家石油化工发展水平的标志性物质,则A为CH2=CH2;乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,乙烯与氢气发生加成反应生成F为C2H6,乙烯与HCl发生生成G为CH3CH2Cl,乙烷与氯气发生取代反应生成氯乙烷;
(5)正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,负极发生氧化反应,乙醇在负极失去电子,碱性条件下生成碳酸根与水.
解答 解:A 常用来衡量一个国家石油化工发展水平的标志性物质,则A为CH2=CH2;乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,乙烯与氢气发生加成反应生成F为C2H6,乙烯与HCl发生生成G为CH3CH2Cl,乙烷与氯气发生取代反应生成氯乙烷.
(1)A为CH2=CH2,含有官能团为:碳碳双键,B为CH3CH2OH,含有官能团为:羟基,故答案为:碳碳双键;羟基;
(2)F为C2H6,在F的同系物中最简单的有机物为甲烷,空间构型为正四面体,故答案为:正四面体;
(3)F为C2H6,与F互为同系物的含5个碳原子的所有同分异构体的结构简式:CH3CH2CH2CH2CH3,CH3CH2CH(CH3)2,C(CH3)4,故答案为:CH3CH2CH2CH2CH3,CH3CH2CH(CH3)2,C(CH3)4;
(4)反应①是乙烯与水发生加成反应生成B为CH3CH2OH,反应方程式为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
反应②是乙醇发生氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,也属于取代反应,
故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,加成;
2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,氧化;
CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化或取代;
(5)工业上常以石墨为电极,KOH溶液为电解质溶液,一端通空气,另一端通CH3CH2OH气体构成原电池,正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,负极发生氧化反应,乙醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3CH2OH+16OH--12e-=2CO32-+11H2O,
故答案为:O2+2H2O+4e-=4OH-;CH3CH2OH+16OH--12e-=2CO32-+11H2O.
点评 本题考查有机物推断,涉及烷烃、烯烃、醇、醛、羧酸之间的转化关系是关键,难度不大,注意基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫氢化钠的水解:HS-+H2O═S2-+H3O+ | |
| B. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O═4OH- | |
| D. | 碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
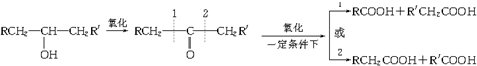
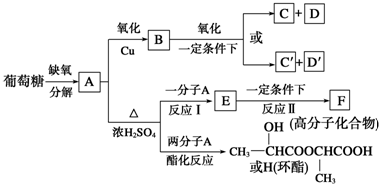
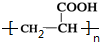 ,H
,H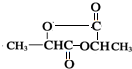 .
.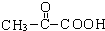 +2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
+2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| B. | 等物质的量的氯气与乙烷在光照条件下反应得到9种产物 | |
| C. | 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种 | |
| D. | 苯乙烯和氢气完全加成的产物的一溴取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),测得最后溶液的pH>7.
向100mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
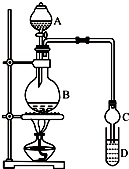 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:已知: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<W<Y<Z | |
| B. | X的氢化物稳定性大于Z的氢化物稳定性 | |
| C. | X在自然界中只能以化合态形式存在 | |
| D. | W的单质可使干燥的红色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  能作为SO2的干燥装置 | |
| B. |  验证铁钉的吸氧腐蚀 | |
| C. |  可用于测量Cu与浓硝酸反应生成NO2的体积 | |
| D. |  可证明酸性:H2SO4>H2CO3>H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com