
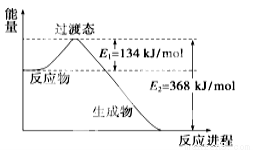
(16 分) (1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-394 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572 kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2600kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1 mol C2H2 (g)反应的焓变:
△H=_____ 。
(3) 4.6 g酒精和一定量的氧气混合点燃,恰好完全燃烧,生成5.4 g水和4.48 L CO2(产物均在标准状况下测定),并放出140 kJ热量,写出表示酒精燃烧热的热化学方程式为 。
(4)中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
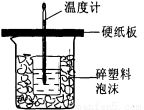
①从实验装置上看,图中尚缺少的一种玻璃用品是___________,烧杯间填满碎塑料泡沫的作用是_________ ________。
②实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是 所求中和热的数值会________(填“相等”或“不相等”)。
(16分)(1)NO2(g) +CO(g)=CO2(g)+NO(g) △H= -234 k J/mol
(2)△H= +226 k J/mol
(3)CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= -1400 k J/mol
(4)① 环形玻璃搅拌棒 隔热,防止热量散失
② 不相等 放出的热量与参与反应的物质的多少有关,所用物质越多,放出热量越多 相等
【解析】
试题分析:(1)根据反应的能量变化示意图可知1 mol NO2和1 mol CO反应生成CO2和NO放出368-134=234kJ的热量,所以热化学方程式为NO2(g) +CO(g)=CO2(g)+NO(g) △H= -234 k J/mol;
(2)C(s,石墨)和H2(g)生成1 mol C2H2 (g)的化学方程式为2C(s,石墨)+ H2(g)= C2H2 (g),根据盖斯定律,消去CO2(g)、H2O(l),该反应的热效应△H=2△H1+△H2/2-△H3/2=+226kJ/mol;
(3)4.6g的酒精的物质的量是0.1mol,则1mol酒精完全燃烧生成水和二氧化碳气体放出的热量是1400kJ,所以酒精燃烧热的热化学方程式为CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H= -1400 k J/mol
(4)①中和热的测定实验中还需要环形玻璃搅拌棒,用于搅拌液体,使其充分反应;烧杯间填满
碎塑料泡沫的作用是保温、隔热,防止热量散失;
②改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液相比,生成的水的物质的量增加,放出的热量与参与反应的物质的多少有关,所用物质越多,放出热量越多,所以放出的热量肯定不相等;而中和热是指生成1mol水放出的热量,与参与反应的物质的多少无关,所以计算得到的中和热的数值相等。,
考点:考查热化学方程式的书写、盖斯定律的应用,中和热的测定


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏大
B.可以采用蒸发浓缩、冷却结晶的方法从高锰酸钾溶液中获得高锰酸钾晶体
C.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌
D.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另—烧杯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:填空题
(10分)
(一)双氧水和水都可看成是极弱的电解质,但H2O2与H2O相比,H2O2显弱酸性。
(1)若把H2O2看成二元弱酸,试写出它在水中的电离方程式 。
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为 。
(二)下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是: 。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的C(OH-)为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应: NH4Br(s)  NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)  Br2(g)+H2(g);2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上
Br2(g)+H2(g);2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上
述反应速率用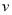 (NH3)表示,下列反应速率正确的是
(NH3)表示,下列反应速率正确的是
A.0.5mol/(L·min) B.2.5mol/(L·min) C.2mol/(L·min) D.5mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数增大,化学反应速率可能增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应活化能,增大活化分子百分数,增大化学反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
某化学课外学习小组设计了电解饱和食盐水的简易装置见下图,下列有关说法正确的是( )
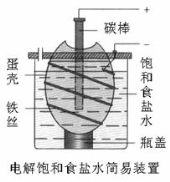
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+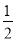 O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
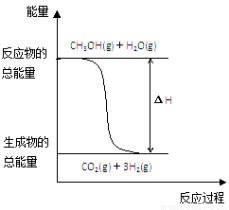
下列说法正确的是
A.若用甲醇(CH3OH)为原料设计成燃料电池,则通入甲醇的电极为正极
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+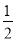 O2(g)===CO2(g)+2H2(g) 的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) 的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
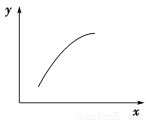
选项 | x | y |
A | MgSO4的质量(忽略体积) | CO的转化率 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(B)试卷(解析版) 题型:填空题
(8分)下列物质中,物质的量最大的是 ,含分子个数最多的是 ,含原子个数最多的是 ,质量最大的是 。
A 6 g H2; B 0.5 mol CO2; C 1.20×1024个HCl分子;
D.147 g H2SO4; E.92 g乙醇(C2H5OH); F.4 ℃时10 mL水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com