
【题目】已知A(g)+B(g)C(g)+D(s)反应的平衡常数与温度的关系如下:
温度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 则2min时c(A)=molL﹣1 , C的物质的量为mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有 a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃ 时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 .
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 . 
【答案】
(1)![]() ;>
;>
(2)0.06;0.1;增大
(3)ad
(4)0.08
(5)700
(6)
【解析】解:(1)由A(g)+B(g)C(g)+D(s),纯固体不能代入K的表达式中,K= ![]() ,由表格数据可知,温度越高,K越大,则正反应为吸热反应,△H>0,所以答案是:
,由表格数据可知,温度越高,K越大,则正反应为吸热反应,△H>0,所以答案是: ![]() ;>;(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 转化的A为0.02mol/L,则
;>;(2)800℃时,K=10.0,初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 转化的A为0.02mol/L,则
A(g)+ | B(g) | C(g)+ D(s) | |
开始 | 0.08 | 0.14 | 0 |
转化 | 0.02 | 0.02 | 0.02 |
2min | 0.06 | 0.12 | 0.02 |
则2min时c(A)=0.06molL﹣1 , C的物质的量为0.02mol/L×5L=0.1mol;此时,Qc= ![]() =2.78<K,平衡正向移动,
=2.78<K,平衡正向移动,
A(g)+ | B(g) | C(g)+ D(s) | |
开始 | 0.08 | 0.14 | 0 |
转化 | X | x | X |
平衡 | 0.08-x | 0.14-x | X |
![]() =10,
=10,
解得x=0.04mol/L,
平衡后A的百分含量为 ![]() ×100%=22.2%,
×100%=22.2%,
反应达到平衡时再向容器中充入0.4molA,平衡正向移动,则
A(g)+ | B(g) | C(g)+ D(s) | |
开始 | 0.04+0.08 | 0.1 | 0.04 |
转化 | X | X | X |
平衡 | 0.12-x | 0.1-x | 0.04+x |
![]() =10.0,
=10.0,
解得x=0.027mol/L,
平衡时A的含量为 ![]() ×100%=39.9%,
×100%=39.9%,
则再次达到平衡后A的百分含量与第一次平衡相比增大,
所以答案是:0.06;0.1;增大;(3)a.该反应为气体体积不等的反应,压强不随时间改变,达到平衡状态,故选; b.v(A):v(b)=1:1始终存在,不能判断达到平衡状态,故不选;c.单位时间内消耗A和B的物质的量相等,只体现正反应速率关系,不能判定平衡,故不选; d.C的百分含量保持不变,可知浓度不变,为平衡状态,故选;所以答案是:ad;(4)880℃时,A(g)+B(g)C(g)+D(s)反应的平衡常数K=12.5,互为相反的两个反应的K互为倒数关系,则880℃时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 ![]() =0.08,所以答案是:0.08;(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K=
=0.08,所以答案是:0.08;(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),可知K= ![]() =1,则该此时的温度为700℃,所以答案是:700;(6)升高温度,反应速率加快,平衡正向移动,平衡时A的物质的量比原平衡的小,在1200℃时A的物质的量的变化曲线图为
=1,则该此时的温度为700℃,所以答案是:700;(6)升高温度,反应速率加快,平衡正向移动,平衡时A的物质的量比原平衡的小,在1200℃时A的物质的量的变化曲线图为  ,所以答案是:
,所以答案是:  .
.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】已知:反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H 3
反应I和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)△H3=(用△H1、△H2的代数式表示);推测反应Ⅲ是反应(填“吸热”或“放热”)
(2)相同条件下,反应I:4NH3(g)+6NO(g)5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示. ①计算0~4分钟在A催化剂作用下,反应速率V(NO)= .
②下列说法不正确的是 .
A.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2. ①保持恒温恒容,再充入NO2气体,NO2体积分数(填“变大”、“变小”或“不变”)
②关于平衡体系反应Ⅱ:2NO(g)+O2(g)2NO2(g);△H2说法正确的是 .
A、该反应焓变为负值
B、升高温度,逆反应速率增大,正反应速率减小,反应逆向移动
C、不论增大压强还是减小压强,正方向速率改变的程度更大
D、平衡正向移动,NO的转化率一定增大
E、平衡体系中加入NO2 , 平衡逆向移动,△H2减小
F、混合气体颜色加深说明平衡向右移动,颜色变浅则向左移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素A、B、C、D、E、F的原子序数依次增大,A和D同族,C和E同族,D离子和C离子具有相同的电子层结构。A和C、E、F均能形成共价型化合物。A和C形成的化合物在水中呈碱性,D和F形成的化合物在生活中常作调味剂,A与B的核外电子数之和等于F的最外层电子数。回答下列问题:(用化学式作答)
(1)A、C、D、E四种元素原子半径的大小的顺序是____________(填元素符号);
(2)由A和E、F所形成的共价型化合物中,热稳定性由强到弱的顺序是_____;
(3)A和F形成的化合物与A和C形成的化合物反应,产物的化学式为_______,产物中存在的化学键类型为_______;
(4)E、F最高价氧化物的水化物的酸性由强到弱的顺序是__________;
(5)C、E氢化物熔沸点的大小关系是______;
(6)F的单质与D的最高价氧化物的水化物反应的离子方程式为__________。
(7)(BC)2称为拟卤素,性质与卤素相似,气体分子(BC)2的电子式为____________,其与氢氧化钠溶液反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( ) 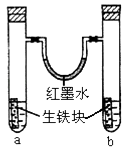
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe﹣2e﹣→Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应:aA(g)+bB(g)cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( ) 
A.T1<T2 , p1<p2 , a+b>c,正反应为吸热反应
B.T1>T2 , p1<p2 , a+b<c,正反应为吸热反应
C.T1<T2 , p1>p2 , a+b<c,正反应为吸热反应
D.T1>T2 , p1>p2 , a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 丁达尔效应不是胶体特有的现象,溶液与浊液也有
B. 胶体与其他分散系的本质区别是有丁达尔效应,而其他分散系没有
C. 胶体粒子的直径小于10-9m
D. 丁达尔效应可用于鉴别胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图: 
已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)当离子浓度≤1×10﹣5molL﹣1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知:Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 molL﹣1KOH液滴定未知浓度的醋酸,其操作分解为如下几步: A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写);
(2)上述B步骤操作的目的是;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是 . (填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为 , 判断到达滴定终点的实验现象是:;
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为mL,图2为滴定结束液面,则本次滴定过程共使用了mLKOH标准溶液 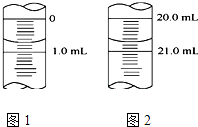
(6)为标定某醋酸溶液的准确浓度,用0.1000molL﹣1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 . (保留小数点后四位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.硝酸钾溶液能导电,所以硝酸钾溶液是电解质
B.石墨有较好的导电性,所以石墨属于电解质
C.液态氯化氢、固态氯化钠均不能导电,所以氯化氢、氯化钠均不是电解质
D.蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com