
室温下,下列指定溶液中微粒的浓度关系正确的是( )
A. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH—)
B. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
C. 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
D. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列各组混合物中,能用分液漏斗进行分离的是
A. 水和CCl4 B. 溴和CCl4 C. 酒精和水 D. 汽油和植物油
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:填空题
磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
I | 320 | 0.40 | 0.10 | 0.10 | t1 |
II | 320 | 0.80 | t2 | ||
III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II____溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
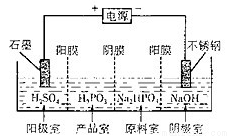
阴极的电极反应式为_______;产品室中反应的离子方程式为__________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______mol/L
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三2月月考理科综合化学试卷(解析版) 题型:选择题
为实现实验目的,选用的装置、实验操作均正确的是( )
实验目的 | 实验步骤和装置 | |
A | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
B | 配制100mL1.0mol/L NaOH溶液 | 向100mL容量瓶中加入4. 0gNaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 比较H2O2 和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:实验题
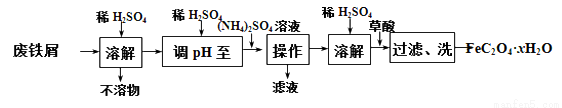
实验室以废铁屑为原料制备草酸亚铁晶体(FeC2O4·xH2O)。过程如下:
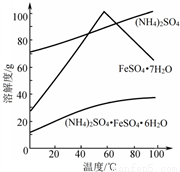
已知:①pH>4时,Fe2+易被氧气氧化;
②相关物质的溶解度曲线如图。
(1)①废铁屑在进行“溶解”前,需要在5%的Na2CO3 溶液中加热数分钟,并洗涤干净,Na2CO3溶液的作用是____________。
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+ 和NH4+的水解;二是 ________。
③操作I是为了得到(NH4)2SO4·FeSO4·6H2O,则操作I应进行蒸发浓缩、结晶、过滤。那么过滤时适宜的温度为__________。
④检验FeC2O4·xH2O沉淀是否洗涤干净的方法是____________。
(2)通常用已知浓度的酸性高锰酸钾溶液测定草酸亚铁晶体的纯度。已知酸性条件下MnO4-转化为Mn2+,写出MnO4-与Fe2+反应的离子方程式:____________。
(3)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4·xH2O。请补充完整由硫铁矿烧渣制备纯净FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤,____________,过滤,得到较纯净的FeSO4溶液。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂, KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
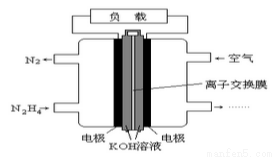
A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为:N2H4+4OH-+4e - =N2+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列有关化学用语正确的是( )
A. 聚丙烯的结构简式: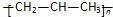
B. 二氧化碳的电子式: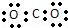
C. 中子数为18的硫原子: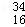 S
S
D. 乙醇的分子式:CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二下学期第一次模块检测化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A. 丙烯的结构简式:C3H6 B. 氢氧根离子的电子式: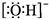
C. 氯原子的结构示意图: D. 中子数为146、质子数为92 的铀(U)原子
D. 中子数为146、质子数为92 的铀(U)原子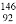 U
U
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
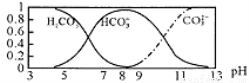
A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D. pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com