
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素,Y与W的最高化合价之和为8,X与Z同主族,且Z的核电荷数是X的2倍。下列说法正确的是( )
A.简单气态氢化物的稳定性:X>ZB.简单离子半径:![]()
C.由X、Y组成的化合物中不含共价键D.最高价氧化物对应水化物的酸性:Z>W
【答案】A
【解析】
由题可知,X、Y、Z、W为原子序数依次增大的短周期主族元素,由X与Z同主族且Z的核电荷数是X的2倍可知,X为O元素,Z为S元素,则W为Cl元素,Y与W的最高化合价之和为8,则Y为Na元素。
A.X的简单气态氢化物为H2O,Z的简单氢化物为H2S,非金属性O>S,则H2O的稳定性大于H2S,A正确;
B.离子半径比较时,核外电子排布相同,序数大半径小;电子层越多,半径越大,因此离子半径大小为S2->Cl->O2->Na+,B错误;
C.X、Y组成的化合物Na2O2中含有共价键,C错误;
D.非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:Cl>S,故最高价氧化物对应水化物的酸性:HClO4> H2SO4, D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X是金属元素,W、Y是不同主族的非金属元素且最外层电子数为偶数,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如下图所示。下列叙述正确的是
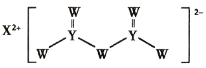
A.W、X离子半径比较:X>W
B.Y、Z的氢化物稳定性比较:Y>Z
C.1mol YW2晶体中含有4mol Y—W键
D.工业上可通过电解熔融XW来生产X的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )

A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗H222.4L(标准状况)时,a极析出铜64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1;SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为__。
②随温度升高,该反应化学平衡常数变化趋势是___。
(2)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是__。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是___(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜、铁、铝等在人类文明史上先后被广泛使用。回答下列问题:
(1)铜、银、金三种金属在元素周期表同族且依次相邻,因此价电子层结构相似。银原子价层电子排布式为________;金元素在周期表的位置是________。
(2)观察如下循环图可以获知FeO的晶格能为________ kJ·mol-1。

(3)氯化铝熔点194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成式为Al2Cl6,其结构式为________;气态氯化铝中存在________(填选项标号)
A.离子键 B.配位键 C.氢键 D.范德华力 E.金属键 F.非极性共价键
(4)石墨微观结构如下图。其中碳原子杂化类型为________。金刚石晶体中碳碳键键长为0.155nm。金刚石的熔点略低于石墨,而远高于C60的原因是________。
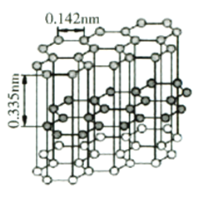
(5)设阿伏加德罗常数值为NA,则石墨的密度为________![]() (列出计算表达式)
(列出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定条件下能大量共存的是( )
A.使甲基橙呈黄色的溶液中:Na+、Fe3+、Cl-、CO32-
B.使pH 试纸显蓝色的溶液中:K+、Na+、NO3-、SO42-
C.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
D. ![]() = 1×1012的溶液中:Fe3+、K+、CO32-、ClO-
= 1×1012的溶液中:Fe3+、K+、CO32-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CuCl2酸性溶液中的FeCl3,加热搅拌的条件下加入一种试剂,然后再加入适量盐酸,该试剂不能是( )
A.Cu(OH)2B.CuCO3C.NaOHD.CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃条件下,向![]() 的盐酸中不断通
的盐酸中不断通![]() ,该过程中水电离出的氢离子浓度
,该过程中水电离出的氢离子浓度![]() 水
水![]() 与通入
与通入![]() 的物质的量关系如图,下列说法不正确的是( )。
的物质的量关系如图,下列说法不正确的是( )。
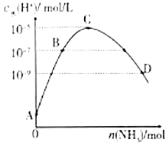
A.![]() 点的纵坐标为
点的纵坐标为![]()
B.![]() 点溶液中
点溶液中![]()
C.![]() 点溶液中
点溶液中![]()
D.![]() 点溶液的
点溶液的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com