

 ,故答案为:
,故答案为: ;
;| 70% |
| 32 |
| 30% |
| 14 |


科目:高中化学 来源: 题型:
| A、将pH试纸直接放在某溶液中,测试该溶液的pH |
| B、分液操作时,先将下层液体从下口放出,然后再换个烧杯将上层液体从下口放出 |
| C、过滤操作时,漏斗下端的尖嘴要紧靠烧杯的内壁 |
| D、用乙醇作萃取剂从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
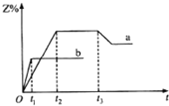 一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )
一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )| A、曲线b表示的是l00℃时的图象 |
| B、该反应的正反应是吸热反应 |
| C、t2时,曲线a、b对应反应速率v(a)>v(b) |
| D、t3时改变的条件可能是增大了压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解MgCl2饱和溶液制取金属镁 |
| B、SO2具有还原性,可使酸性KMn04溶液退色 |
| C、双氧水被称为绿色氧化剂,是因为其还原产物为O2 |
| D、新制备的氯水中存在三种分子、四种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新能源具有可再生和无污染等特点,所以应大力提倡采用太阳能、风能和生物质能 |
| B、加高工厂的烟囱,使烟尘和废气远离地表,可减少环境污染 |
| C、可利用分光光度计,通过比色法测定化学反应速率 |
| D、在海伦外壳镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.
A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业常采用合适的催化剂 |
| B、配制FeCl2溶液时在溶液中加入少量铁粉 |
| C、NO2与N2O4的平衡体系加压,气体颜色会变深 |
| D、向重铬酸钾溶液中滴加几滴氢氧化钠溶液后,溶液由橙色变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com