
| A、达到平衡时,反应速率v正(X)=2v正(Z) |
| B、平衡常数K值越大,X的转化率越大 |
| C、反应速率v正(X)=2v逆(Z),该反应达到平衡状态 |
| D、给反应体系加热,平衡常数不变 |


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯化钡溶液与硫酸反应:Ba2++SO
| ||
| B、金属镁与稀盐酸反应:Mg+2H++2Cl-=MgCl2+H2↑ | ||
| C、碳酸钠溶液与盐酸反应:Na2CO3+2H+=2Na++H2O+CO2↑ | ||
| D、氢氧化镁与硫酸溶液反应:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②④ |
| C、①③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ |
| C、①④⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C>D>A>B |
| B、原子序数:C>D>B>A |
| C、离子半径:D>C>B>A |
| D、单质的还原性:B>A>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
| A、51 | B、92 |
| C、143 | D、235 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3 |
| B、CuSO4 |
| C、MgSO4 |
| D、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |

| 充电 |
| 放电 |
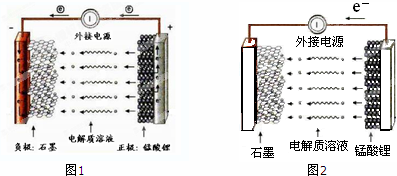
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com