
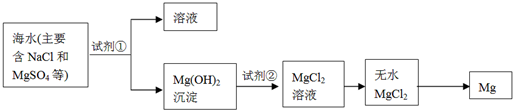
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤,洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。 下列说法正确的是
A.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
B.上述变化过程中包括了分解、化合、复分解、置换等四种反应类型
C.在氯化氢热气流中干燥晶体的目的是为了加快干燥速度
D.步骤⑤也可以采用电解该盐水溶液的方法
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
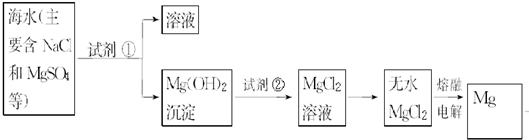
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
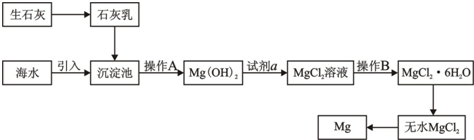
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
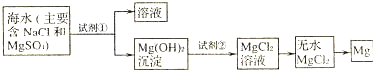
| 方法 | 是否正确 | 简述理由 |
| 方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
| 方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
| 你认为最合理的其他方法是:(四) | ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| ||
| 2800℃ |
| △ |
| ||
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| ||
| 还原 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
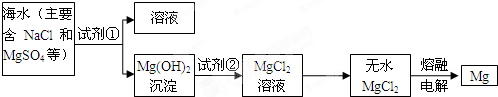
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com