
|
用20 mL 2 mol·L-1的H2SO4溶液与20 mL 3 mol·L-1的Na2CO3溶液反应来制取CO2,欲制得最多的CO2,则下列操作正确的是 | |
| [ ] | |
A. |
把20 mL Na2CO3溶液缓缓滴加到20 mL H2SO4溶液中 |
B. |
把20 mL H2SO4溶液缓缓滴加到20 mL Na2CO3溶液中 |
C. |
把两种溶液快速混合并不断搅拌 |
D. |
把两种溶液缓慢混合并不断搅拌 |
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:河南省卫辉市第一中学2010-2011学年高一3月月考化学试题 题型:013
|
用20 mL 0.1 mol/L的含氧酸HxRO4溶液与15 mL 0.2 mol/L的某碱M(OH)a溶液恰好完全反应,全部生成正盐,则R元素的化合价是 | |
| [ ] | |
A. |
+(8-) |
B. |
+(8-2a) |
C. |
+(8-) |
D. |
+(8-3a) |
查看答案和解析>>
科目:高中化学 来源:广东省汕头市金山中学2011-2012学年高二上学期12月月考化学试题 题型:022
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A.根据题意回答下列问题:
(1)写出酸H2A的电离方程式________.
(2)Na2A的水溶液呈________性,原因是(用离子方程式表示):________往Na2A溶液中加入________可抑制其水解
A.NaOH固体
B.氯化铁固体
C.水
D.碳酸钠固体
已知K sp(BaA)=1.8×10-10,往20 mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1.(忽略A2-的水解)
(3)若溶液M由2 mol·L-1 H2A溶液与2 mol·L-1 NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为________.
(4)若溶液M由下列三种情况:
①0.01 mol·L-1的H2A溶液;
②0.01 mol·L-1的NaHA溶液;
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为________.
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于”“等于”“小于”或“均有可能”).
查看答案和解析>>
科目:高中化学 来源:2010年高一“每周一练”系列(19)化学试题 题型:058
某化学实验小组为测定三个不规则容器的容积,甲、乙、丙三个小组分别利用以下几个实验完成.试回答有关问题:
(1)甲组:先用托盘天平,称得容器的质量为m g,再充满H2O,称得容器和H2O的总质量为n g,则容器的容积为________.
(2)乙组:先用排空气法充满一容器标准状况下的HCl气体,然后做喷泉实验,(溶液不扩散)所得溶液用标准NaOH(0.10 mol/L)溶液滴定,消耗NaOH溶液20 mL.
①容器的容积为________.
②该实验原理可能存在的缺陷是________________.
(3)丙组:把35.1 g NaCl放入500 mL烧杯中,加入150 mL蒸馏水.待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器.从中取出溶液100 mL,该溶液恰好与20 mL 0.100 mol·L-1 AgNO3溶液完全反应.试计算该容器的体积.
查看答案和解析>>
科目:高中化学 来源:福建省厦门外国语学校2012届高三11月月考化学试题 题型:022
运用相关原理,回答下列各小题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-.
(1)在NaHSO4溶液中c(H+)________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH________7.
(2)将20 mL pH=2的NaHSO4溶液逐滴加入到20 mL 0.1 mol·L-1 Na2CO3溶液中,溶液中发生反应的离子方程式为:________;向此反应后的溶液中滴加0.001 mol·L-1 BaCl2溶液,首先析出的沉淀是________.[KSP(BaSO4)=1.1×10-10 mol2·L-2;KSP(BaCO3)=5.1×10-9 mol2·L-2]
Ⅱ.已知:在25时H2O![]() H++OH-KW=10-14
H++OH-KW=10-14
CH3COOH![]() H++CH3COO→Ka=1.8×10-5
H++CH3COO→Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为________.当升高温度时,Kh将________(填“增大”“减小”“不变”);
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为________,a与b的关系为________(填“大于”“小于”“等于”);
(5)0.9 mol·L-1醋酸钠溶液中[OH-]=________mol·L-1在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01 mol·L-1.向其中加入固体醋酸钠,使其浓度为0.9 mol·L-1,以上三种金属离子中________能生成沉淀,原因是________.
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、![]() =2.2)
=2.2)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:计算题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图6所示。请回答下列问题
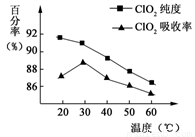
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400
mL ClO2溶液,取出20 mL,加入37.00 mL
0.500 mol· (NH4)2Fe(SO4)2
溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2
溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=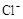 +5Fe3+
+2H2O
+5Fe3+
+2H2O
14H+ +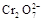 +6
Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6
Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com