
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
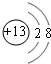
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k![]() J。 该反应的热化学方程式为________。K^S*5U.C#O%
J。 该反应的热化学方程式为________。K^S*5U.C#O%
【答案】
(1)
(2)![]()
(3)![]() (或其它合理答案)K^S*5U.C#O%
(或其它合理答案)K^S*5U.C#O%
(4)①![]()
或![]()
②a和c;a或c
(5)![]()
![]()
【解析】
(1)J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素,即为铝元素,根据J、R周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族。K^S*5U.C#O%
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为![]() 。
。
(3)M和T形成的化合物为![]() ,与水反应
,与水反应![]() ,其中氯化氢气体成雾状。K^S*5U.C#O%
,其中氯化氢气体成雾状。K^S*5U.C#O%
(4)①氨水与双氧水发生氧化还原反应![]() 生成无污染的氮气;②甲在固体体积的密闭容器中发生分解反应(
生成无污染的氮气;②甲在固体体积的密闭容器中发生分解反应(![]() ),
),![]() 表明正反应为吸热反应,升高温度,平衡朝正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝正方向移动,甲物质的量减少;加入![]() 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小。K^S*5U.C#O%
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小。K^S*5U.C#O%
(5)![]() 为
为![]() ,燃料生成二氧化碳和二氧化硫,依题意可以很快地写出反应的热化学方程式
,燃料生成二氧化碳和二氧化硫,依题意可以很快地写出反应的热化学方程式![]()
![]() 。
。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
 (2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.

 Al(OH)3+3HCl
Al(OH)3+3HCl Al(OH)3+3HCl
Al(OH)3+3HCl| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入N2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.

查看答案和解析>>
科目:高中化学 来源: 题型:
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||||
| M | R |

| 选项 | a | b | c | d |
| x | 温度 | 加入H2的物质的量 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com