
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催化剂为(填序号) . a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程 .
【答案】
(1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3)![]()
(4)ab
(5)![]()
【解析】解:(1)电子层数越多半径越大,电子层数相同,核电荷数越多半径越小,可知O<Al<Na,所以答案是:Na>Al>O; 所以答案是:O<Si<Al;(2)元素周期表中,同周期从左到右元素的非金属性逐渐增强,同主族从上到下元素的非金属性逐渐减弱,则非金属性的强弱顺序为N>C>Si,非金属性越强,对应最高价氧化物的水化物的酸性越强,故有酸性H2SiO3<H2CO3<HNO3 , 所以答案是:HNO3>H2CO3>H2SiO3;(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等,NaOH的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)过氧化氢在MnO2、FeCl3等做催化剂的条件下易发生分解生成氧气,而Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,所以答案是:a b;(5)用电子式表示①、④两种元素形成18电子是过氧化氢,其形成过程
;(4)过氧化氢在MnO2、FeCl3等做催化剂的条件下易发生分解生成氧气,而Na2SO3具有还原性,与过氧化氢反应生成钠硫酸,高锰酸钾具有氧化性,氧化过氧化氢生成氧气,不能用来做催化剂,所以答案是:a b;(5)用电子式表示①、④两种元素形成18电子是过氧化氢,其形成过程 ![]() ,所以答案是:
,所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1)NaClO2的化学名称为 .
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10﹣3molL﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(molL﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 . 增加压强,NO的转化率(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是 .
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压p0如图所示.
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”、“不变”或“减小”).
②反应ClO2﹣+2SO32﹣═2SO42﹣+Cl﹣的平衡常数K表达式为 .
(4)如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
②已知下列反应:
SO2(g)+2OH﹣(aq)═SO32﹣(aq)+H2O(l)△H1
ClO﹣(aq)+SO32﹣(aq)═SO42﹣(aq)+Cl﹣(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42﹣(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO﹣(aq)+2OH﹣(aq)═CaSO4(s)+H2O(l)+Cl﹣(aq)的△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1mol X和1mol Y混合于2L的密闭容器中,发生如下反应 2X(g)+Y(g)=nZ(g)+2W(g),2min末X的物质的量为0.2mol,以Z的浓度表示的反应速率为0.1mol/(Lmin) 请回答:
(1)前2min以X的浓度表示的平均反应速率
(2)n值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃. 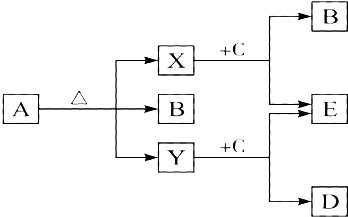
(1)写出下列物质的化学式:A , B , C , D , E .
(2)写出A受热分解的化学方程式: .
(3)写出Y与C反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应,下列叙述中不正确的是( ) ①放热的反应发生时不必加热
②化学反应一定有能量变化
③吸热反应需要加热后才能发生
④化学反应热效应数值(放出或吸收的热量)与参加反应的物质的多少有关.
A.①②
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示: 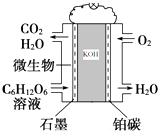
(1)电池工作时,石墨电极上发生(填“氧化”或“还原”)反应,
(2)阳离子移向(填“石 墨”或“铂碳”)电极,
(3)该电池负极电极上反应的电极反应式为 .
(4)当有8mol电子发生转移时消耗的氧气在标况下为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化工生产的主要设备及尾气的主要成分完全正确的是
A.炼铁—电炉—CO、CO2、N2
B.氨气—氧化炉—N2、H2
C.炼钢—转炉—Fe2O3、CO
D.硫酸—合成塔—SO2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是抗心律失常药物泰达隆的医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )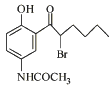
A.分子中含有1个手性碳原子
B.可以与FeCl3溶液反应生成有颜色的物质
C.在热的KOH溶液中,能发生消去反应
D.1 mol化合物X最多能与2molBr2发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com