
【题目】已知N2O4(无色)![]() 2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )
2NO2(红棕色) 现有如右图所示的三个烧瓶,分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(I)中加入无水CaO,在(III)中加入NH4Cl晶体,(II)中不加其他任何物质,发现(I)中红棕色变深,(III)中红棕色变浅,下列叙述正确的是 ( )

A. CaO溶于水时吸收热量 B. 该反应的ΔH>0
C. NH4Cl溶于水时放出热量 D. 烧瓶(III)中气体的压强增大
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 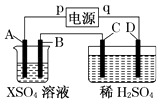
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于A(g)+2B(g)![]() 3C(g)的化学反应,下列表示的反应速率最快的是( )
3C(g)的化学反应,下列表示的反应速率最快的是( )
A. v(A)=0.6 mol/(L·min) B. v(B)=0.3 mol/(L·s)
C. v(C)=0.9 mol/(L·min) D. v(C)=1.2 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述,错误的是
A.任何化学反应都有一定的限度B.化学反应的限度与时间的长短无关
C.化学反应的限度是不可改变的D.可逆反应达到限度时,正逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子中有 n 个CH 2 , m 个 ![]() ,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3 , 其余为OH,则该物质分子中OH的个数可能为( )
A.m﹣a
B.n+m+a
C.m+1﹣a
D.m+2﹣a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞中元素的叙述,错误的是
A. 硅藻和水稻细胞中Si元素的含量较多
B. 细胞中含量最多的四种元素是C、O、H和N
C. 组成细胞的化学元素没有一种为细胞特有
D. 活细胞中含量最多的化学元素是C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( ) 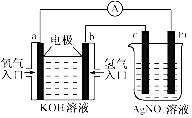
A.该装置中Pt极为阳极
B.当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L
C.该装置中b极的电极反应式是:H2+2OH﹣﹣2e﹣=2H2O
D.该装置中a极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。
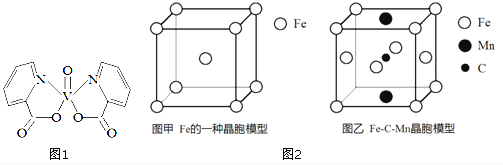
【答案】  O>N>C>H C、N 2NA bcd 体心立方密堆积
O>N>C>H C、N 2NA bcd 体心立方密堆积 ![]() 4 Fe23Mn8C8
4 Fe23Mn8C8
【解析】I. (1). V是23号元素,其价层电子排布式为3d34s2,价层电子轨道表示式为 ,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为:
,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为: ;O>N>C>H;
;O>N>C>H;
(2). 由图1可知,该分子中的C原子和N原子的σ键数均为3且没有孤电子对,所以C原子和N原子的杂化轨道数目均为3,采取sp2杂化,由图1可知,V与N原子之间形成配位键,1个分子中含有2个配位键,则1mol分子中含有2mol配位键,数目为2NA,故答案为:C、N;2NA;
(3). 该物质是电中性分子,分子之间存在范德华力,由图1可知,该物质的晶体中除配位键外,分子内的不同非金属原子之间形成极性共价键,同种非金属原子之间形成非极性共价键,不存在金属键和氢键,故答案为:bcd;
II. (4). 由Fe的晶胞结构示意图可知,晶胞中Fe的堆积方式为体心立方密堆积,晶胞中Fe原子的个数为:8×![]() +1=2,则晶胞的质量为:
+1=2,则晶胞的质量为:![]() ×56g,设晶胞的棱长为x cm,则
×56g,设晶胞的棱长为x cm,则![]() ×56g=ρg·cm-3×(x cm)3,解得x=
×56g=ρg·cm-3×(x cm)3,解得x=![]() cm,故答案为:体心立方密堆积;
cm,故答案为:体心立方密堆积;![]() ;
;
(5). 由图乙可知,体心的C原子与面心的Fe原子距离最近,则与C原子等距紧邻的Fe原子个数为4,该晶胞中Fe原子个数为7×![]() +4×
+4×![]() =
=![]() ,C原子个数为1,Mn原子数目为2×
,C原子个数为1,Mn原子数目为2×![]() =1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
=1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
点睛:本题主要考查物质结构和性质,涉及电子排布式、电负性、杂化方式、配合物、晶胞结构和有关计算,试题难度不大。本题的易错点是第(5)小题,在利用均摊法计算晶胞中原子个数时,要注意该晶体有缺陷,即有一个顶点未排列Fe原子。
【题型】综合题
【结束】
12
【题目】香料G的一种合成工艺如下图所示。

A 的分子式为C5H8O其核磁共振氢谱显示有两种峰。其峰面积之比为1: 1.
已知:CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_________。
(2)A的结构简式为_______。
(3)写出下列转化的化学方程式:D→E_____________________
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有____种。(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_______、________。
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个取代基
(6) 以2-丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)__________。
请用以下方式表示: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com