
| A. | 在标准状况下,1mol水和1molH2的体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气体一定处于标准状况 | |
| D. | 在标准状况下,1gH2和11.2LO2的物质的量相等 |
分析 A、气体摩尔体积只适用于气体;
B、状态不知,所以无法求体积的大小;
C、根据pV=nRT可知,1mol气体的体积为22.4L,所处的条件有很多,不一定是标准状况;
D、在标准状况下,1gH2的物质的量为$\frac{1g}{2g/mol}$=0.5mol,而11.2LO2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol.
解答 解:A、气体摩尔体积只适用于气体,而水是液体,故A错误;
B、2g氢气和44g二氧化碳的均为1mol,但温度、压强会影响气体的体积,个二者体积不一定相等,故B错误;
C、1mol气体的体积为22.4L,根据pV=nRT可知,满足条件的T、P很多,不一定是标准状况,故C错误;
D、在标准状况下,1gH2的物质的量为$\frac{1g}{2g/mol}$=0.5mol,而11.2LO2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,所以两者的物质的量相等,故D正确;
故选D.
点评 本题考查气体摩尔体积、阿伏伽德罗定律及推论,难度中等,注意利用pV=nRT理解阿伏伽德罗定律及推论.


科目:高中化学 来源: 题型:选择题
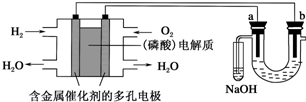
| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,a电极周围首先放电的是Cl-,而不是Br- | |
| C. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.02 g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
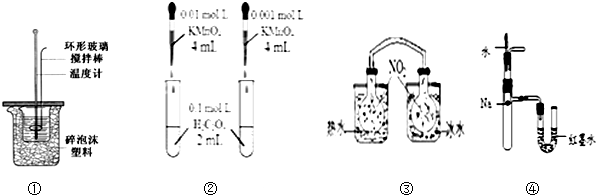
| A. | 装置①用于测定中和热装置 | |
| B. | 装置②依据褪色快慢比较浓度对反应速率的影响 | |
| C. | ③依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| D. | 装置④依据U管两边液面的高低判断Na和水反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2 Na2CO3 盐酸 AgNO3 | |
| B. | BaCl2 Na2CO3 AgNO3 盐酸 | |
| C. | Na2CO3盐酸 AgNO3 BaCl2 | |
| D. | AgNO3盐酸 BaCl2 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用图示的装置进行电解,通电一段时间后,发现Pt电极上有气泡冒出.
用图示的装置进行电解,通电一段时间后,发现Pt电极上有气泡冒出.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质 | 非电解质 | 化合物 | |
| A | H2SO4 | Cl2 | NaCl |
| B | NaOH | 酒精 | N2 |
| C | CuSO4 | 水银 | CO2 |
| D | BaSO4 | 蔗糖 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
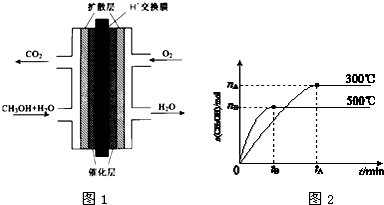
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com