
����Ŀ���������ũҩ�˰�������Ҫ�м��壮��ϳ�·�����£� 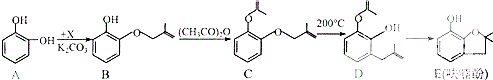
��1��A���ʺ˴Ź��������и������շ�ķ����֮��Ϊ �� B��C�ķ�Ӧ������ �� E�к��������ŵ������� �� 1molD����������molNaOH��
��2����֪X�ķ���ʽΪC4H7Cl��д��A��B�Ļ�ѧ����ʽ�� ��
��3��Y��X��ͬ���칹�壬��������֧���Ҳ���������Y������ȥ��Ӧ���ò�������ƣ�ϵͳ�������� ��
��4�������йػ�����C��D��˵����ȷ���� �� �ٿ����Ȼ�����Һ����C��D
��C��D���еĹ�������ȫ��ͬ
��C��D��Ϊͬ���칹��
��C��D����ʹ��ˮ��ɫ
��5��E�ж���ͬ���칹�壬д��������������������ͬ���칹��Ľṹ��ʽ �� �����ڷ����廯����
�ڱ����ϵ�һ�ȴ���ֻ��һ��
�ۺ�������
���ܷ���������Ӧ��
���𰸡�
��1��1��1��1��ȡ����Ӧ���ǻ����Ѽ���3
��2��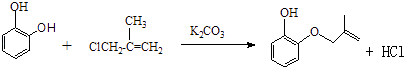
��3��1��3������ϩ
��4���٢ۢ�
��5��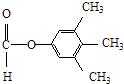 ��
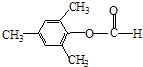
�� 
���������⣺��1��A����Ϊ�Գƽṹ�������к���3����ԭ�ӣ���˴Ź���������3�����շ壬����֮��Ϊ1��1��1�������Գƣ����Ա�B��C�Ľṹ��֪��B�зө�OH�ϵ�H��ȡ����B��C�ķ�Ӧ����ȡ����Ӧ����E�Ľṹ��֪�����еĹ��������ǻ����Ѽ���D���б�����̼̼˫�������ܺ��������Ʒ�����Ӧ�����з��ǻ��ܺ���������1��1��Ӧ����ѡ�ܣ����Դ��ǣ�1��1��1��ȡ����Ӧ���ǻ����Ѽ���3����2���Ա�A��B�Ľṹ����֪A��B����ȡ����Ӧ����XΪCH2=CH��CH3��CH2Cl����Ӧ����HCl���ɣ���Ӧ����ʽΪ�� 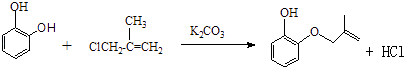 �����Դ��ǣ�
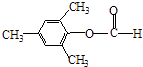
�����Դ��ǣ� 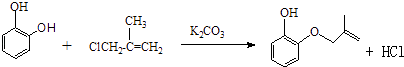 ����3��Y��X��ͬ���칹�壬��������֧���Ҳ���������YΪCH2=CHCH2CH2Cl��������ȥ��Ӧ��ȥ��ԭ�Ӽ�������̼�ϵ���ԭ���γ�̼̼˫��CH2=CHCH=CH2 �� 1��3̼�Ϻ���˫��������ϵͳ����Ϊ��1��3������ϩ�����Դ��ǣ�1��3������ϩ����4����C�������ǻ�����D���з��ǻ��������Ȼ�����Һ������ɫ��Ӧ���������Ȼ�����Һ����C��D���ʢ���ȷ����C�����Ѽ���D���з��ǻ������ߺ��й����Ų���ȫͬ���ʢڴ���C��D����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʢ���ȷ����C��D������̼̼˫���������巢���ӳɷ�Ӧ������ʹ��ˮ��ɫ���ʢ���ȷ�����Դ��ǣ��٢ۢܣ���5��E�ķ�����ͬ���칹�����㣺�����������ܷ���������Ӧ�����м����γɵ��������һ��ϵ�һ�ȴ���ֻ��һ�֣����E�Ľṹ��֪��Ӧ������4��������Ϊ�Գƽṹ������������ͬ���칹��Ϊ��
����3��Y��X��ͬ���칹�壬��������֧���Ҳ���������YΪCH2=CHCH2CH2Cl��������ȥ��Ӧ��ȥ��ԭ�Ӽ�������̼�ϵ���ԭ���γ�̼̼˫��CH2=CHCH=CH2 �� 1��3̼�Ϻ���˫��������ϵͳ����Ϊ��1��3������ϩ�����Դ��ǣ�1��3������ϩ����4����C�������ǻ�����D���з��ǻ��������Ȼ�����Һ������ɫ��Ӧ���������Ȼ�����Һ����C��D���ʢ���ȷ����C�����Ѽ���D���з��ǻ������ߺ��й����Ų���ȫͬ���ʢڴ���C��D����ʽ��ͬ���ṹ��ͬ����Ϊͬ���칹�壬�ʢ���ȷ����C��D������̼̼˫���������巢���ӳɷ�Ӧ������ʹ��ˮ��ɫ���ʢ���ȷ�����Դ��ǣ��٢ۢܣ���5��E�ķ�����ͬ���칹�����㣺�����������ܷ���������Ӧ�����м����γɵ��������һ��ϵ�һ�ȴ���ֻ��һ�֣����E�Ľṹ��֪��Ӧ������4��������Ϊ�Գƽṹ������������ͬ���칹��Ϊ�� 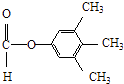 ��
��  �����Դ��ǣ�
�����Դ��ǣ�  ��
��  ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʳ�ַ�Ӧ����ˣ�����Һ���ȡ��������������䣬���ղ��ܵõ����������(����)
A.��Ư����Һ��ͨ�����CO2
B.���������Ĥ����Ƭ�м�������
C.��1mol Ca(HCO3)2����Һ�м���1mol Na2O2
D.��1 mol KAl(SO4)2����Һ�м���2 mol Ba(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ����־��������40GPa��ѹ�£��ü��������ȵ�1800K���Ƶþ��и��۵㡢��Ӳ�ȵĶ�����̼���壮���й��ڸþ����˵����ȷ���ǣ� ��
A.�þ������ڷ��Ӿ���
B.�þ������������������������
C.һ�������£��þ���ɸ��������Ʒ�Ӧ
D.ÿĦ���þ����к�5 mol C��O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������еĸ����������������ͼ�����߱�ʾ���ǣ� ��
�� Ӧ | ������ | �� | �� | |
A | ��ͬ�����İ�����ͬһ������ | ������ת���� | 500�� | 400�� |
B | �������ء��Ʒֱ�������ˮ��Ӧ | H2���� | �� | �� |
C | ���¶Ⱥ�ѹǿ����ͬ�ļ����������зֱ�Ͷ�������1��3��N2��H2��N2+3H2�T2NH3�� | ���������ʵ��� | ��Ӧ�����б��ֺ��º��� | �� Ӧ�����б��ֺ��º�ѹ |
D | 2molSO2��1molO2 �� ����ͬ�¶��� | SO3 ��Ũ�� | 2������ѹ | 10������ѹ |
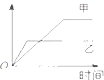
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л������ʹ���Ը��������Һ����ʹ��ˮ������ѧ��Ӧ��ɫ����
A. �� B. �ױ� C. ��ϩ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ�ص�ԭ�����γ�AB2�����ӻ��������( )
A.6��8B.11��16C.9��11D.9��12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣�
�ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeO��Cr2O3 �� �����й衢�������ʡ��Ʊ�������ͼ��ʾ��
�ش��������⣺
��1������ٵ���Ҫ��ӦΪ��
FeO��Cr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
������Ӧ��ƽ��FeO��Cr2O3��NaNO3��ϵ����Ϊ���ò��費��ʹ���մ�������ԭ������
��2������1�к������Ľ���Ԫ���� �� ����2����Ҫ�ɷ������������ʡ�
��3������ܵ���Һ2��pHʹ֮�������С������ԭ�����������ӷ���ʽ��ʾ����
��4���й����ʵ��ܽ����ͼ��ʾ������Һ3���м�������KCl������Ũ������ȴ�ᾧ�����˵õ�K2Cr2O7���塣��ȴ�������ţ��õ���K2Cr2O7�����Ʒ��ࡣ
a.80�� b.60�� c.40�� d.10��
����ݵķ�Ӧ��������
��5��ij������m1 kg ������ۣ���Cr2O3 40%���Ʊ�K2Cr2O7 �� ���յõ���Ʒ m2 kg������Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�ҽ�����Ԫ��Pb��Kr��ԭ�Ӻ˶�ײ�������һ��������Ϊ118��������Ϊ175�ij���Ԫ�ء���Ԫ��ԭ�Ӻ��ڵ�����������������֮����
A. 293B. 47C. 61D. 57
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com