
 如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:分析 甲为燃料电池,通入二氧化硫的以及为负极,被氧化,生成硫酸,电极方程式为SO2+2H2O-2e-═SO42-+4H+,通入氧气的以及为原电池的正极,发生还原反应,电极反应式为:O2+4e-+4H+=2H2O,乙为电解池,铁为阴极,发生还原反应生成银,C为阳极,发生还原反应生成氧气,以此解答该题.
解答 解:(1)二氧化硫具有还原性,为原电池的负极,电极方程式为SO2+2H2O-2e-═SO42-+4H+;
故答案为:负;SO2+2H2O-2e-═SO42-+4H+;
(2)C棒与正极氧气相连为阳极,发生氧化反应,反应为2H2O-4e-=O2↑+4H+,所以滴紫色石蕊试液,碳电极附近的现象是溶液变红,NO3-移向阳极C棒,铁与负极相连为阴极,发生还原反应生成银,总反应为4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,故答案为:C;还原反应;溶液变红;4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+;
(3)n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,由电极方程式电极方程式为Ag++e-═Ag可知转移0.05mol电子,由O2+4e-+4H+=2H2O可知,甲池中通入O2在标准状况下的体积为0.05mol×$\frac{1}{4}$×22.4L/mol=0.28L=280mL,由乙池总反应4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,得溶液中氢离子浓度为$\frac{0.05}{0.5}$=0.1mol/L,所以PH=1,故答案为:280;1;
点评 本题综合考查原电池、电解池知识,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握原电池的工作原理,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 | |
| B. | 1 mol O2在反应中得到电子数一定为4 NA | |
| C. | 1 mol Cl2在反应中得到电子数不一定为2NA | |
| D. | 在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物,每生成1 mol Cl2转移2 NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:2 | B. | 2:2:3 | C. | 1:3:4 | D. | 3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
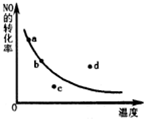 已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1 mol N2(g)和 1 mol O2(g)反应放出的能量为 180 kJ | |
| B. | 1 mol N2(g)和 1 mol O2(g)具有的总能量小于 2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和 O2(g)混合能直接生成 NO(g) | |
| D. | NO 是一种酸性氧化物,能与 NaOH 溶液反应生成盐和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com