
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
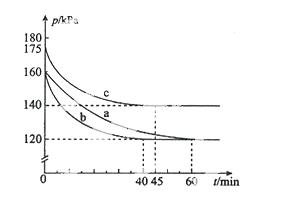
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a和c的平衡转化率:αa为 、αc为 。
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
有下列各组物质:
A.O2和O3 B. C和
C和 C
C
C.CH3-CH2-CH2-CH3和CH3-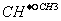 -CH3
-CH3
D.Br- Br和H-
Br和H- Br E.甲烷和庚烷 F.CH3-
Br E.甲烷和庚烷 F.CH3-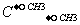 CH3和C(CH3)4
CH3和C(CH3)4
G.CH3COOH与HCOOCH3 H.金刚石与石墨
回答下列问题:
(1)________组互为同位素; (2)________组属于同系物;
(3)________组互为同分异构体; (4)________组是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是 ( )。
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验③、④说明该原电池中铜为正极、锌为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
已知
C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )
A.-332 B.-118 C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1 mol CuCl(s),放出44.4KJ,该反应的热化学方程式是 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取。写出该反应的离子方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释
④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥食物腐败
A.②③④⑤⑥ B.②③④
C.②⑤⑥ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2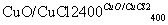 2Cl2+2H2O
2Cl2+2H2O
(1)已知:反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
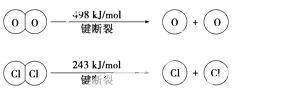
①H2O的电子式是________。
②反应A的热化学方 程式是______________________
程式是______________________ ____________________________。
____________________________。
③断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为________ kJ, H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
A. Na+ B.SO42- C. Ba2+ D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通 电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是________。
电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是________。
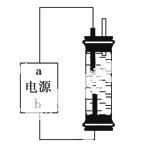
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com