
 氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,目前,消除氮氧化物的方法有多种.| 化学键 | O═O | C═O | C≡O |
| 键能(Kj/moL) | 497 | 803 | 1072 |
分析 Ⅰ、(1)根据反应热=反应物的总键能-生成物的总键能,可得反应2CO+O2=2CO2的反应热,再用盖斯定律可得反应2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H;
(2)①根据图表可知,反应在10min达到平衡,列三段式,由v=$\frac{△c}{△t}$计算反应速率,由化学平衡常数概念计算;
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,计算此时,反应的浓度商与K比较判断反应进行方向;
Ⅱ、二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识书写反应方程式,通过化学反应方程式计算.
解答 解:Ⅰ、(1)根据图表键能数据,反应2CO+O2=2CO2的反应热为2×1072kJ•mol-1+497kJ•mol-1-4×803kJ•mol-1=-571kJ•mol-1,
则已知:①N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
②2CO(g)+O2(g)=2CO2(g))△H=-571kJ•mol-1
根据盖斯定律②-①可得2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-751kJ•mol-1;
故答案为:-751;
(2)①向体积为1L的密闭容器中通入2molNO、1molCO,由图可知,反应在10min达到平衡,列三段式:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
c始:2 1 0 0
c转:0.4 0.4 0.2 0.4
c平:1.6 0.6 0.2 0.4
则前10分钟内用氮气表示的反应速率为$\frac{0.2mol/L}{10min}$=0.02mol?L-1?min-1;K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$;
故答案为:0.02mol?L-1?min-1;$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$;
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,
则:此时:C(NO)=3.2mol/L;C(CO)=0.6mol/L;C(CO2)=0.8mol/L;C(N2)=0.2mol/L;
反应的浓度商为$\frac{0.2×0.{8}^{2}}{3.{2}^{2}×0.{6}^{2}}$=$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$,说明反应达到平衡,则V正=V逆;
故答案为:=;
II、二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4Na2SO3═N2+4Na2SO4;结合化学反应2NO+ClO2+H2O=NO2+HNO3+HCl知道,N2~2NO2~2ClO2,所以若生成11.2L即0.5molN2(标准状况),则消耗1molClO2质量是1mol×67.5g/mol=67.5g;
故答案为:2NO2+4Na2SO3═N2+4Na2SO4;67.5.
点评 本题考查了反应热、反应平衡的计算,氧化还原反应的相关计算,题目综合性强,明确化学平衡移动原理读取题目信息是解题关键,题目难度中等


科目:高中化学 来源: 题型:选择题
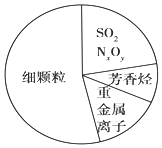
| A. | 雾霾天气不能产生丁达尔现象 | |
| B. | 重金属离子对人体的危害主要是造成蛋白质的变性 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,可杜绝雾霾的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
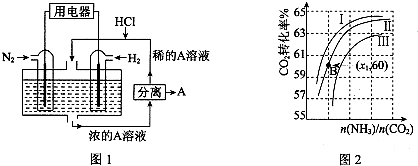
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
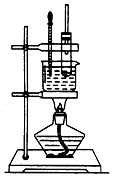 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚呈弱酸性,能够使石蕊试液显红色 | |
| B. | 提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| C. | 苯酚能够与氯化铁溶液反应生成紫色沉淀 | |
| D. | 苯酚分子中的13个原子可能处于同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com