
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
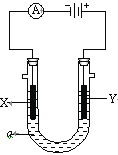
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。(说明:杂质发生的电极反应不必写出)
【答案】(1)①2H++2e-=H2↑无色溶液变红②2Cl-+2e-=Cl2↑ 用湿润的淀粉KI试纸检验,若试纸变蓝,证明生成Cl2(2)纯铜 Cu2++2e-=Cu 粗铜 Cu-2e-=Cu2+
【解析】
试题分析:(1)①X、Y都是惰性电极,a是饱和NaCl溶液,X电极与电源的负极相连,则是阴极,发生反应2H++2e-=H2↑,X极附近氢氧根离子浓度增大,则会观察到无色溶液变红;
②Y电极作阳极,电极反应为2Cl-+2e-=Cl2↑,检验氯气的方法是用湿润的淀粉KI试纸检验,若试纸变蓝,证明生成Cl2;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极材料是粗铜,阴极材料是纯铜;则
① X电极的材料是纯铜,电极反应式是Cu2++2e-=Cu;
② Y电极的材料是粗铜,电极反应式是Cu-2e-=Cu2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过氧化氢被称为绿色氧化剂,它的分子结构如下图所示。已知该分子H-O-O键角都是97°。下列有关H2O2的说法正确的是
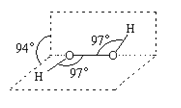
A.过氧化氢分子中存在离子键、共价键
B.在1.00mol H2O2中,核外电子总数为10×6.02×1023个
C.过氧化氢既有氧化性又有还原性
D.3.4g过氧化氢中含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O == BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
体系 pH | 不同温度下的半衰期(min) | |||
0℃ | 25℃ | 50℃ | 75℃ | |
8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。

温度较低时主要反应①:N2H4 + O2 ![]() N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平衡常数为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中![]() 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
①该电池的负极反应式是______________;
②在电池中,Na+不断移动到“水”电池的_______极(填“正”或“负”);
③外电路每通过4mol电子时,生成Na2Mn5O10的物质的量是______________。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如右图所示。

①该电池工作时,b口通入的物质为______________。
②该电池负极的电极反应式______________。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为浓硫酸与铜片反应的装置。请回答:
(1)浓硫酸与铜片反应的化学方程式为 。

(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为___________________;
(2)已知:①E-E→2E;△H=+a kJmol-1
②2A→A-A;△H=-b kJmol-1
③E+A→A-E;△H=-c kJmol-1(“”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式___________________;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g);△H=-d Jmol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K的值为_____;
②三个容器中的反应分别达平衡时各组数据关系正确的是_____(填序号)
A.α1+α2=1 B.α3<α1 C.n2<n3<1.0mol D.P3<2P1=2P2 E.Q1+Q2=d F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min到新平衡时X的物质的量浓度的变化曲线。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2 ![]() 2CO2+3H2O。下列说法不正确的是
2CO2+3H2O。下列说法不正确的是
A.C2H5OH在电池的负极上参加反应 B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极 D.电池正极得电子的物质是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
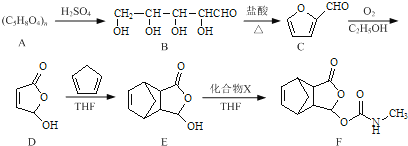
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应X+Y=Z的能量变化情况,某同学设计了如图所示装置。当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升。试回答下列问题:
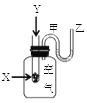
(1)该反应为______反应(填“放热”或“吸热”)。
(2)X和Y的总能量比Z的总能量_______(填“高”或“低”)。
(3)物质中的化学能通过_____转化成_______释放出来。
(4)反应物化学键断裂吸收的能量____于生成物化学键形成放出的能量(填“高”或“低”)。
(5)己知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1molO=O键完全断裂时吸收能量496kJ,水蒸气中1molH-O键形成时放出能量463kJ,则氢气中1molH-H键断裂时吸收能量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com