
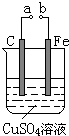
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,碳棒上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,在电路中通过0.5mol电子后反接,又通过1mol电子,此时溶液中的c(H+)是2mol•L-1(假定溶液体积不变) |
分析 若a和b连接,该装置是原电池,铁作负极,碳作正极,负极上铁失电子发生氧化反应,正极上铜离子得电子发生还原反应;若a和b不连接,铁和铜离子发生置换反应生成铜单质,铜片上无明显现象,据此分析解答.
解答 解:A.a、b不连接,未形成原电池,Cu2+与Fe在接触面上直接反应:Fe+Cu2+=Fe2++Cu,故A正确;
B.a和b用导线连接时,组成了原电池,Fe作负极,C作正极,碳棒上发生还原反应:Cu2++2e-=Cu,铁片上发生氧化反应:Fe-2e-=Fe2+,故B正确;
C.通过以上分析可知,无论a和b是否连接,均发生反应:Fe+Cu2+=Fe2++Cu,故溶液均从蓝色(Cu2+的颜色)逐渐变成浅绿色(Fe2+的颜色),故C正确;
D.a和b分别连接直流电源正、负极时,构成电解池,通过0.5mol电子时,阳极产生0.5molH+,阴极析出0.25molCu;调整后,阴极变阳极,0.25molCu放电时通过0.5mol电子,又通过0.5mol电子时Fe放电;阳极变阴极,通过1mol电子阴极上析出0.5molCu.故溶液中共产生0.5 molH+,c(H+)=0.5 mol?L-1,故D错误.
故选:D.
点评 本题考查电化学,意在考查考生对原电池、电解池的电极反应、现象和电极反应式的书写等的掌握情况,根据电极上得失电子及其反应类型来分析解答,注意活泼电极作电解池阳极上发生的反应,为易错点.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题

 .
.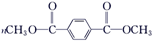 +
+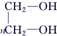 $\stackrel{H+}{?}$
$\stackrel{H+}{?}$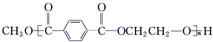 +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种. 合成
合成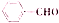 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

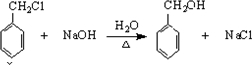 ;
;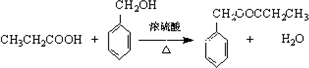 .
.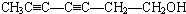 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 常温下W与H形成的化合物1mol与水完全反应生成气体的质量为2克 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NaClO | B. | NaCl、NaClO3 | C. | NaClO、NaClO3 | D. | NaClO3、NaClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
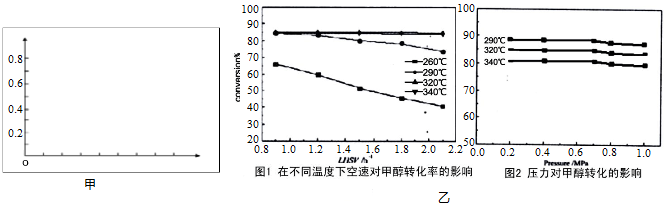
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A. | 电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极b流向电极a | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b | |
| D. | 当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com