


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、该原子核内质子数为12 |
| B、原子的质量数为24 |
| C、该原子在化学反应中易得电子 |
| D、该元素在化合物中显-2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
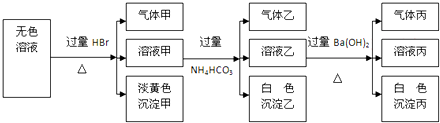
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
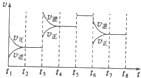 甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.物质 | CH3OCH3(g) | H20(g) | |
| 浓度(mol?L-1) | 0.60 | 0.60 |
| 容器 | 甲2 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCO、4molH2 |
| CH3OH | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
| t1-t2 | t4-t5 | t5-t6 | t7-t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH-用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3+3H+明矾净水 |
| C、TiCl4+(x+2)H2O(过量)═TiO2?xH2O↓+4HCl 制备TiO2纳米粉 |
| D、SnCl2+H2O═Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com