
常温下,0.2 mol·L-1的盐酸30mL分别与下列Na2CO3溶液混合,再加水稀释到100mL,其中最初产生CO2的速率最快的是
A.20mL0.3 mol·L-1Na2CO3 B.10mL0.4 mol·L-1Na2CO3
C.25mL0.4 mol·L-1Na2CO3 D.15mL0.5 mol·L-1Na2CO3
C
【解析】
试题分析:0.2 mol·L-1的盐酸30mL分别与Na2CO3溶液混合,再加水稀释到100mL时,就只考虑每一种Na2CO3溶液所含有的Na2CO3的物质的量的多少,含有的Na2CO3的物质的量的越多,溶液的浓度越大,最初产生CO2的速率最快:A、20mL*0.3 mol·L-1=0.006 mol Na2CO3 B、10mL*0.4 mol·L-1=0.004 mol Na2CO3,C、25mL*0.4 mol·L-1=0.01 mol Na2CO3 D、15mL*0.5 mol·L-1=0.0075 mol Na2CO3,所以C项溶液中含有的Na2CO3的物质的量最多,最初产生CO2的速率最快,正确。
考点:考查浓度对化学反应速率的影响。


科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
已知X,Y声是元素周期表中前20号元素:|x-y|=3, X, Y能形成化合物M,下列说法正
确的是
A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径
B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性
C.若M属于共价化合物,则该分子中原子个数比可能为1:2
D.若M属于离子化合物,则该化合物中只存在离子键
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:填空题
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
下列表述不正确的是( )
A.131I与127I互为同位素,化学性质几乎相同
B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素
C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶
D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
已知:25℃,101KPa下,固体白磷、固体红磷分别充分燃烧,放出热量如下:
①P(s,白磷)+5/4 O2(g)= 1/4 P4O10(s) 放出755.2kJ的热
②P(s,红磷)+5/4 O2(g)= 1/4 P4O10(s) 放出738.5kJ的热
据此判断下列说法中正确的是
A.由白磷变红磷是吸热反应
B.白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热
C.等质量时,白磷比红磷具有的能量高
D.等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
下列物质中既含有非极性键,又含有离子键的是
A.MgBr2 B.H2O2 C.Na2O2 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:填空题
(13分)有机合成中增长碳链是一个重要环节。如下列反应:
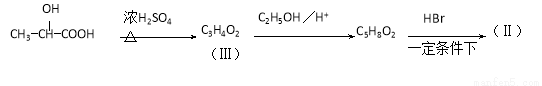
用  通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):
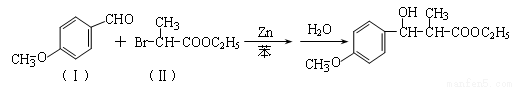
(1)(Ⅰ)的分子式为 ;(Ⅲ)的结构简式为 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(3) 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,反应类型是 。
(4)(Ⅰ)的一种同分异构体(Ⅳ)能发生银镜反应,还能水解生成不含甲基的芳香化合物。(Ⅳ)的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省绍兴市柯桥区高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(15分)浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:

操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称: ;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当 时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是 (用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。
(4)下列因素对测定水样中的COD能产生影响的有 (用相应编号填写)
①硫酸的用量 ②反应装置中的锥形瓶在反应前用蒸馏水洗涤
③重铬酸钾的用量 ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示:

将上述实验步骤A到F按实验过程先后次序排列
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)= mg/L
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省温州市业水平考试适应性测试化学试卷(解析版) 题型:选择题
下列与试验操作相关的描述中,正确的是
A.制乙酸乙酯时,迅速将乙醇注入浓硫酸中
B.在石油蒸馏装置中,将温度计水银球插入液面以下
C.用铂丝蘸取少量KCl溶液置于火焰上灼烧,直接观察火焰颜色,检验K+的存在
D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com