
分析 (1)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式;
②依据两个热化学方程式结合题干数据列式计算得到;
(2)利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得;物质的能量越低越稳定.
解答 解:(1)①已知:C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ/mol①
H2O(1)=H2O(g)△H=+44.0kJ/mol②
由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol,
故答案为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=-2044kJ/mol;
②H2和C3H8的混合气体共5mol,设氢气物质的量为x,丙烷物质的量为(5-x),完全燃烧生成液态水时放热6262.5kJ
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol
1 285.8kJ
x 285.8xkJ
⑦C3H8(g)+5O2(g)═3CO2(g)+4H2O(1)△H=-2220.0kJ•mol-1
1 2220.0kJ
5-x 2220.0(5-x)kJ
285.8xkJ+2220.0×(5-x)kJ=6262.5kJ
解得:x=2.5mol;
混合气体中H2和C3H8的体积比=2.5:2.5=1:1;
故答案为:1:1;
(2)已知:P4(s,白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ•mol-1 ①,
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ/mol②,
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1
从上面的热化学方程式可见,相同状况下,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定,
故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1; P(s,红磷); 低.
点评 本题考查了热化学方程式的书写及计算,题目难度中等,明确盖斯定律的含义为解答关键,注意掌握热化学方程式的书写原则,能够根据盖斯定律计算、书写目标反应的热化学方程式.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径C>D>B>A | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
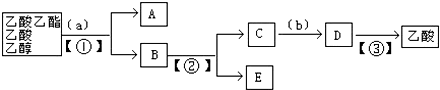
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C3H6 | C. | C6H6 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ MnO4- Cl- SO42- | B. | Na+ AlO2- Cl- SO42- | ||
| C. | SO42-Na+ HCO3-Ba2+ | D. | Na+ NO3- NH4+ SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>D>C | B. | 金属性B>D,非金属性A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:C>B>D>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
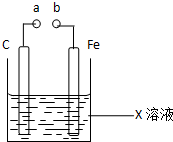
| A. | X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应 | |
| B. | X如果是CuSO4,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| C. | X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源的正、负极时,H+的移动方向均相同 | |
| D. | X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 1 | 2 | 3 | 4 |
| 模型示意图 |  |  |  |  |
| A. | 模型1对应的物质的二氯代物有2种 | |
| B. | 模型2对应的物质的官能团是羧基 | |
| C. | 模型2对应的物质可与模型3对应的物质发生酯化反应 | |
| D. | 模型4对应的物质可以与氯气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com