
【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,在循环过程中价态变化在-2价至+6价之间,以不同的状态(或形态)发生一系列的变化,请分析此图并回答有关问题,
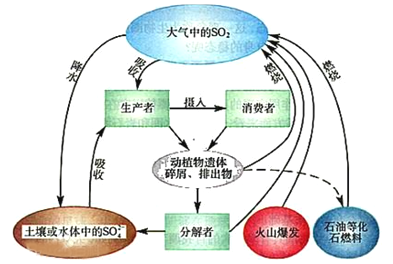
(1)硫循环与氮循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是_____
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 碳循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为硫化氢,硫黄细菌和硫化细菌可将硫化氢进一步转变为元素硫或硫酸盐,下列关于硫化氢说法正确的是 _____________
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外层都达到8电子结构
C.将硫化氢通入硫酸亚铁溶液,产生沉淀
D.硫化氢中硫元素为-2价,因此只有还原性,没有氧化性
E.硫化氢是一种无色臭鸡蛋气味的有毒气体
(3)硫化氢虽然有毒,但有研究发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用,请再举出一例类似硫化氢“亦正亦邪”物质的实证______________________。
(4)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。收集某次酸雨样品,发现8小时内,样品pH一直在较小,其原因可能是_____________________。(用化学方程式表示)
(5)研究发现,空气其中少量的NO2也能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用不符的是___________(多选)
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热
D.向盐酸中加入浓硫酸产生白雾
(6)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______。

(7)若采用如图所示的流程处理则气体a是_______________,Y一定含有______________。(填化学式)
【答案】 C E 二氧化硫具有漂白性能够用于纸浆漂泊,但是能够造成酸雨 2H2SO3+O2→2H2SO4 ABCD CaSO4 SO2 (NH4)2SO4、H2SO4
【解析】(1)人类活动对碳循环和硫循环都造成了巨大影响,硫的燃烧产生二氧化硫,会产生酸雨,二氧化碳不会导致酸雨,蛋白质中含有碳、氢、氧、氮、磷、硫等元素,所以碳、硫两种元素都能以无机物和有机物的形式参与循环,故选C;
(2)A.硫化氢不稳定,加热易分解,生成氢气和硫,故A错误;B.硫化氢中氢原子最外层为2个电子,故B错误;C.将硫化氢通入硫酸亚铁溶液,无沉淀产生,原因是弱酸不能制强酸,故C错误;D.硫化氢中硫元素为-2价、氢为+1价,因此既有还原性,又有氧化性,故D错误;E.硫化氢是一种无色臭鸡蛋气味的有毒气体,故E正确;答案为E;
(3)SO2有漂白性能用于纸浆漂白,但SO2易造成酸雨;
(4)SO2溶于水生成亚硫酸,亚硫酸是弱酸,易被空气中氧气氧化为硫酸,硫酸是强酸,反应方程式为2H2SO3+O2→2H2SO4,故酸雨样品,放置过程中,pH一直在变小;
(5)①SO2+NO2=SO3+NO,该反应二氧化氮中氮元素的化合价降低,所以二氧化氮作氧化剂;将方程式①×2+②+③得方程式为:2SO2+H2O+O2=SO3+H2SO4,所以二氧化氮在整个反应过程中起催化剂的作用;A.潮湿的氯气通过盛有浓H2SO4的洗气瓶,浓硫酸作干燥剂,故A错误;B.硫化氢通入浓H2SO4中,浓硫酸能氧化硫化氢气体,浓硫酸作氧化剂,故B错误;C.浓H2SO4滴入萤石(CaF2)中,加热制取HF,是利用强酸制取弱酸,故C错误;D.向盐酸中加入浓硫酸产生白雾是利用浓硫酸溶解于水放热,故D错误;故选ABCD;
(6)S燃烧生成SO2,SO2和CaO在高温下化合生成亚硫酸钙,亚硫酸钙再被氧气氧化为CaSO4 ,即最终产物为CaSO4 ;
(7)X为亚硫酸铵,溶解于稀硫酸生成的气体为SO2,同时得到硫酸铵,即Y中一定含有 (NH4)2SO4和过量的H2SO4。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中![]() =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积常数KW=____________,该温度____________25 ℃。(填“>”、“=”或“<”)
(3) 在(2)所述温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合。若所得混合液的pH=10,则Va∶Vb=___________。
(4) 常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在答题卷的图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物品或设备:
①陶瓷餐具 ②砖瓦③水泥路桥 ④门窗玻璃⑤水晶镜片 ⑥石英钟表⑦玛瑙手镯 ⑧硅太阳电池⑨光导纤维 ⑩计算机芯片
(1)用到硅单质的是 .
(2)所用材料为SiO2或要用到SiO2的是
(3)所用材料为硅酸盐的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.AgNO3 B.NaCl C.CuCl2 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
PET是世界上产量最大的合成纤维,其结构简式为:
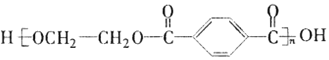
现以煤的干馏产品A与F为原料制备PET,生产的工艺流程如图所示。
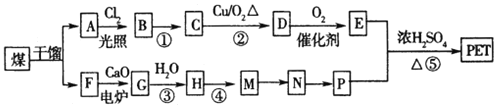
其中A为烃,含碳元素的质最分数为90.6%,其蒸气密度是空气密度的3.66倍,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。
请回答下列问题:
(1)A的名称为______。M→N的反应类型为______ ;
(2)反应①的反应条件为:______;
(3)写出有机物A所有一氯代物的结构简式:______。
(4)写出下列反应的化学方程式:
反应②:_________;反应③:_________。D与足量的氢氧化铜悬浊液煮沸:_________;
反应⑤:_________。
(5)P的一种同系物X的分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2:l : l 。则X的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验装置的说法中正确的是
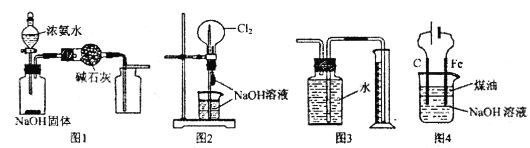
A. 图l装置可制取干燥纯净的NH3
B. 图2装置可以完成“喷泉”实验
C. 图3装置可测量Cu与浓硝酸反应产生气体的体积
D. 图4装置可用于实验室制备Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30ml 0.5mol/L NaOH溶液稀释到500ml,稀释后取出5ml,则溶液中NaOH的物质的量浓度为 ( )
A. 0.03mol/L B. 0.3mol/L C. 0.05mol/L D. 0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制高能量电池,已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法
B.热还原法
C.热分解法
D.铅热法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组的同学们利用下图装置,探究不同条件对铁与酸反应速率的影响。

请回答下列问题。
(1)铁与稀硫酸反应的离子方程式是_______________________________________。
(2)适当升高烧瓶内液体的温度,产生气泡的速率将__________(填“加快、”“减慢”或“不变”),由此得出的结论是______________________________________________。
(3)将稀硫酸换为浓硫酸,可观察到_______________,原因是_________________。
(4)向烧瓶中滴入几滴CuSO4溶液,产生气泡的速率明显加快。这是什么原因?
甲同学:CuSO4溶液中的Cu2+对铁与稀硫酸的反应起了催化作用。
乙同学:CuSO4与Fe反应生成了Cu,从而Fe、Cu、稀硫酸构成了原电池,使反应速率加快。
你同意_______的观点,欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量_____,观察现象。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com