
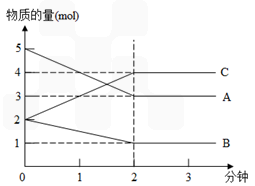
科目:高中化学 来源: 题型:
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
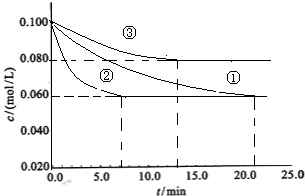
| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究 不同温度 不同温度 对镁与盐酸反应速率的影响;b.实验①和③是探究 不同浓度 不同浓度 对镁与盐酸反应速率的影响;c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 298 298 |
0.20 0.20 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
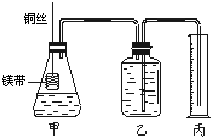 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
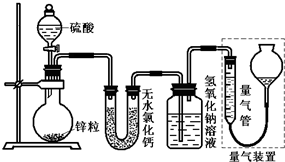 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10l kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10l kPa,温度为0℃).查看答案和解析>>
科目:高中化学 来源: 题型:
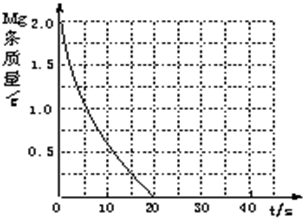
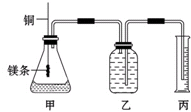 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com