
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
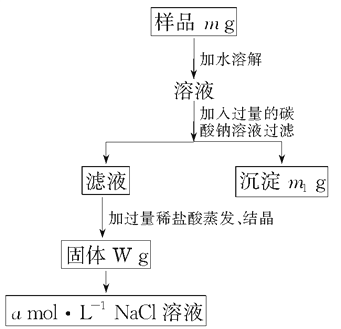
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
【答案】 托盘天平 引流 蒸发皿 出现大量晶体 使钙离子完全形成沉淀而除去 CaCl2+Na2CO3===CaCO3↓+2NaCl 除去过量的Na2CO3 CO32-+2H+===H2O+CO2↑ 5.9 g 100 mL容量瓶
【解析】(1)称量固体的仪器为:托盘天平。
(2)过滤时要使用玻璃棒:引流。
(3)蒸发操作时应将液体放在蒸发皿中加热,等出现大量晶体时即停止加热,利用余热使水分蒸干。故答案为:蒸发皿;出现大量晶体。
(4)NaCl固体中含有少量CaCl2,溶解后,加入过量的Na2CO3溶液,使钙离子完全形成沉淀而除去,反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl。
(5)过滤,滤液中主要成分为NaCl和少量未反应完的Na2CO3,加入稀盐酸除去过量的Na2CO3,反应的离子方程式为:CO32-+2H+=H2O+CO2↑。
(6)配制100 mL 1 mol/L的NaCl溶液,需NaCl的质量m=cVM=1 mol/L×0.1L×58.5g/mol=5.85g。由于托盘天平的精确度为0.1g,故称量5.9g。配制100mL一定物质的量浓度的溶液应在100mL容量瓶中定容。故答案为:5.9g;100mL容量瓶。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,X与M同主族,Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。清回答下列问题:
(1)Q的元素符号为______,Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)_______。
(2)Y在元素周期表中的位置为_______________,Y与硫元素形成的二元化合物的电子式为_________________________。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____________。
(4)单质Y和元素Z的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为_________。
(5)Z和G组成的化合物GZ,被大量用于制造电子元件。工业上用G的氧化物、Y单质和Z单质在高温下制备GZ,其中G的氧化物和Y单质的物质的量之比为1∶3,则该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
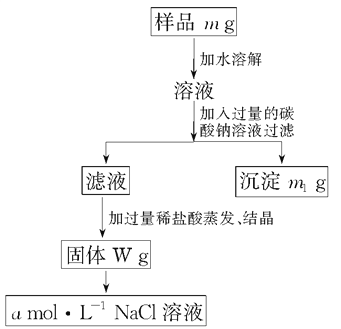
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
⑴工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法 已知:H2S(g) ![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图1。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i S2的结构式为______,该反应的△H_____0(填“>”、“<”或“=”);
ii 计算 985 ℃时H2S按上述反应分解的平衡常数K=________;
iii 比较H2S的速率大小:v(a-逆)______v(b-正) ,v(b-逆)______v(c-正) (填“>”、“<”或“=”);
iiii 说明随温度的升高,曲线b向曲线a逼近的原因:___________;
②电化学法

i该法制氢过程如图2。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为___________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是( )
①. 标准状况下,22.4LSO3中含有的原子数目为4NA
② 在常温常压下,48g 氧气和臭氧的混合气体含氧原子数是3NA
③1molCl2参加反应转移电子数一定为2NA
④ lmolNa2O2 与水充分反应转移的电子数为2NA
⑤ 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA
⑥ 4℃时,22.4 L水中含有的电子数目为 10 NA个
⑦ 使2.3g钠变为 Na+,需失去0.1NA个电子
⑧ 10g46%乙醇水溶液中所含氢原子数目为0.6NA
A. ①②③⑧ B. ②③⑦⑧ C. ②⑦ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C内分别充入等质量的X、CO2、Y三种气体,当隔板静止时,A、C内的气体密度相等。下列说法不正确的是

A. 物质的量:n(X)<n(CO2)<n(Y)
B. 分子数目:N(X)=N(Y)
C. 气体的体积:V(X)=V(Y)
D. 摩尔质量:M(X)=M(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油井发生火灾,产生的大量废气中含有以下成分(①浓烟中的炭粒、②氮的氧化物、③碳的氧化物、④硫的氧化物、⑤碳氢化合物的蒸气),其中对大气造成污染并导致雨水酸化的有害、有毒气体是( )
A. ①③⑤ B. ②④ C. ②③④ D. ②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com