
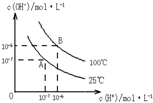
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:| Kw |
| C(OH-) |
| Kw |
| C(OH-) |
| 10-12 |
| 0.01 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:海南省琼海市嘉积中学2011-2012学年高二上学期教学质量监测(二)化学试题 题型:022
在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示:
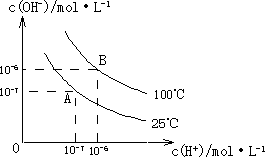
(1)A点水的离子积为1×10-14,B点水的离子积为________.造成水的离子积变化的原因是________.
(2)25℃时,H2R在水溶液中的电离方程式为:
H2R=H++HR-,HR-![]() H++R2-
H++R2-
①0.1 mol/L H2R溶液的pH________1(“>”、“<”或“=”).
②在0.1 mol/L NaHR溶液中,各离子浓度由大到小的顺序是:________.
(3)100℃时,0.01 mol/L NaOH溶液的pH=________.
(4)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为________.
查看答案和解析>>
科目:高中化学 来源:海南省嘉积中学2010-2011学年高二教学质量监测化学理科试题(二) 题型:022
在水的电离平衡中,c(H+)和c(OH-)的关系如下图所示:
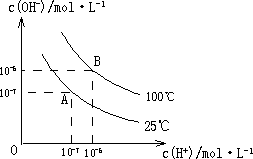
(1)A点水的离子积为1×10-14,B点水的离子积为________.造成水的离子积变化的原因是________.
(2)25℃时,H2R在水溶液中的电离方程式为:
H2R=H++HR-,HR-①0.1 mol/L H2R溶液的pH________1(填“>”、“<”或“=”).
②在0.1 mol/L NaHR溶液中,各离子浓度由大到小的顺序是:________.
(3)100℃时,0.01 mol/L NaOH溶液的pH=________.
(4)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com