
| A. | 只能是7 | B. | 只能是15 | C. | 是11或15 | D. | 是11或13 |
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 1.0 | 0 |
| 2s末浓度(mol/L) | 1.8 | 0.6 | 0.8 |
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子是处于最低能量状态的原子 | |
| B. | 基态C原子的电子排布式是1s22s12p3 | |
| C. | 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 | |
| D. | 同一原子处于激发态时的能量一定低于基态时的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
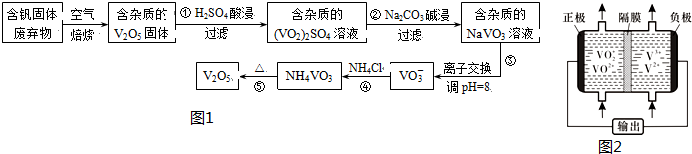
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再滴入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 加AgNO3溶液后未加稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com