
 .
.
分析 A、B、D、E、G原子序数依次增大的五种短周期元素,A的原子半径与G的原子半径之比最小,则A为H元素;B、D、E三种元素原子的电子层数相同,B元素形成的某种单质可做饰品,则B为C,形成的单质为金刚石,E与A、B、D、G均能形成多种常见化合物,则E为O,所以D为N;G与氧形成氧化钠、过氧化钠,所以G为Na,
(1)Na2O2是钠离子和过氧根离子构成的离子化合物;
(2)B2A2为C2H2,实验室利用碳化钙与水反应制备乙炔;
(3)甲为过氧化氢,分解时既有氧化性又有还原性;
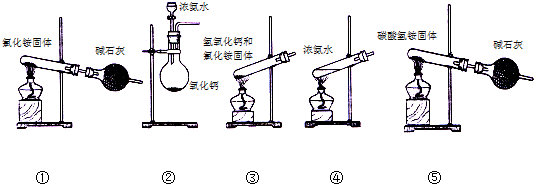
(4)l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则乙为NH3•H2O,丙为NaOH,NaOH中含有离子键,极性共价健,制备氨气,可用加入浓氨水,浓氨水与氧化钙以及氯化铵和氢氧化钙的方法制备,加热固体时,试管口应略向下倾斜;
(5)A、B两元素形成的含18个电子的气态化合物为C2H6,在碱性电池中为负极,发生氧化反应;
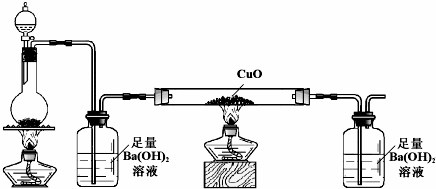
(6)化合物戊是由A、B、E三种元素按原子个数比为1:1:2组成的一种酸,戊在常温下为固体.已知在含1mol 戊的水溶液中加入1mol Na2CO3恰好反应生成正盐,应为H2C2O4,为二元酸,实验时两个广口瓶中均产生白色沉淀;玻璃管中固体变为红色.说明有CO和生成CO2.
解答 解:A、B、D、E、G原子序数依次增大的五种短周期元素,A的原子半径与G的原子半径之比最小,则A为H元素;B、D、E三种元素原子的电子层数相同,B元素形成的某种单质可做饰品,则B为C,形成的单质为金刚石,E与A、B、D、G均能形成多种常见化合物,则E为O,所以D为N;G与氧形成氧化钠、过氧化钠,所以G为Na,
(1)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
(2)B2A2为C2H2,实验室利用碳化钙与水反应制备乙炔,反应为CaC2+2H2O→Ca(OH)2+HC≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(3)常温下液态化合物甲只含上述元素中的两种,分子中原予个数比为1:1,则甲为过氧化氢,分解时既有氧化性又有还原性,该反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则乙为NH3•H2O,丙为NaOH,NaOH中含有离子键,极性共价健,制备氨气,可用加入浓氨水,浓氨水与氧化钙以及氯化铵和氢氧化钙的方法制备,加热固体时,试管口应略向下倾斜,只有②④⑤正确,
故答案为:离子键、极性键; ②④⑤;
(5)A、B两元素形成的含18个电子的气态化合物为C2H6,在碱性电池中为负极,负极反应为C2H6-14e-+180H-=2CO32-+12H2O,
故答案为:C2H6+18OH--14e-=2CO32-+12H2O;
(6)化合物戊是由A、B、E三种元素按原子个数比为1:1:2组成的一种酸,戊在常温下为固体.已知在含1mol 戊的水溶液中加入1mol Na2CO3恰好反应生成正盐,应为H2C2O4,为二元酸,实验时两个广口瓶中均产生白色沉淀;玻璃管中固体变为红色.说明有CO和生成CO2,反应的方程式为HOOC-COOH$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O,
故答案为:H2C2O4;HOOC-COOH$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O.
点评 本题综合考查无机物的推断、物质的性质实验设计等知识,侧重于学生的分析、实验能力的考查,涉及位置、结构、性质的综合应用,难度较大,综合性较强,元素的推断是解答的关键,并熟悉氧化还原反应、化学键、原电池及化学用语等知识点来解答.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
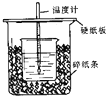 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | |||||
| 其他 | 阳离子 核外无电子 | 无机非金属材料的主角 | 焰色反 应呈黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准 状况下的体积) |
| c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次 称量读数为2.33g |
| 阴离子符号 | 物质的量浓度(mol•L-1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com