
| A. | Cl一的结构示意图: | B. | CH4分子的球棍模型: | ||
| C. | 氯化镁的电子式: | D. | 8个中子的碳原子的核素符号:12C |
分析 A.氯离子的核电荷数为17,不是18;
B. 为甲烷的比例模型;
为甲烷的比例模型;
C.氯化镁为离子化合物,阴阳离子需要标出离子所带电荷,阴离子需要标出最外层电子;
D.8个中子的碳原子的质量数为14,不是12.
解答 解:A.氯离子的核电荷数为17,核外电子总数为18,其正确的离子结构示意图为: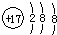 ,故A错误;
,故A错误;
B.甲烷为正四面体结构,分子中存在4个碳氢键,甲烷的球棍模型为: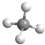 ,故B错误;
,故B错误;
C.氯化镁属于离子化合物,化学式中存在阴阳离子,氯化镁的电子式为: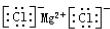 ,故C正确;
,故C正确;
D.碳原子的质子数为6,8个中子的碳原子的质量数为14,该核素符号可以表示为:614C,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、球棍模型与比例模型、电子式及元素符号等知识,明确常见化学用语的概念及书写原则为解答关键.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| B. | 铝盐在水中可产生胶体,可用于自来水的杀菌消毒 | |
| C. | 太阳能热水器、沼气的利用、乙醇汽油都涉及生物质能的利用 | |
| D. | 李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与A | B. | C与D | C. | D与B | D. | B与C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋蒸熏对房间消毒杀菌 | |
| B. | SO2通入品红中溶液变为无色 | |
| C. | 红糖水中加入活性炭溶液变为无色 | |
| D. | 少量胆矾粉末加入到浓硫酸中固体变白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com