
| A、自然界硅元素的贮量丰富 |
| B、硅可用于制造光导纤维 |
| C、高纯度的单质硅被广泛用于制作计算机芯片 |
| D、硅可由二氧化硅还原制得 |
科目:高中化学 来源: 题型:
2- 8 |
- 3 |
2- 4 |
- 3 |
| 实验编号 | ① | ② | ③ | ④ | ||
| 起始浓度c(I-)/(mol/L) | 0.040 | 0.080 | 0.080 | 0.080 | ||
起始浓度c(S2O
| 0.040 | 0.040 | 0.060 | 0.080 |
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸 | B、盐酸 |
| C、氢氧化钠 | D、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅是非金属元素 |
| B、二氧化硅对应的水化物是可溶性弱酸 |
| C、二氧化硅能和强碱反应生成盐和水 |
| D、二氧化硅不能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
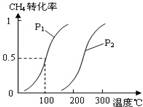 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | (℃) | n (CO)/n(H2) | P(MPa) | ||
| ⅰ | 150 |
| 0.1 | ||
| ⅱ | 5 | ||||
| ⅲ | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、酒精灯打翻着火,用水灭火 |
| D、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
| A、NH3的生成速率与H2的生成速率相等 |
| B、单位时间内生成n mol N2同时生成3n mol H2 |
| C、N2、H2、NH3浓度不再变化 |
| D、N2、H2、NH3分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变 | ||
| C、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | ||
| D、温度升高至800℃,上述反应平衡常数为0.64,则正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com