
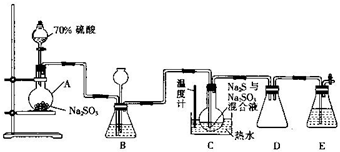
 Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.
Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.分析 工业上常利用含硫废水生产Na2S2O3•5H2O,利用装置A制备二氧化硫,把分液漏斗中的浓硫酸滴入烧瓶中亚硫酸钠中反应得到二氧化硫气体,二氧化硫通入B装置,装置B的作用之一是观察SO2的生成速率,实验中为使SO2缓慢进入烧瓶C,需要控制控制滴加硫酸的速率,通入装置C发生反应烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (Ⅲ)
当S完全反应后表明反应达终点,所以此时应看到的现象为溶液变为澄清,反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,得到硫代硫酸钠,装置D是防止倒吸的安全瓶,装置E是吸收剩余气体,防止污染空气,
(1)根据装置图可知仪器A的名称;
(2)根据压强差原理检验装置的气密性;
(3)D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(4)观察SO2的生成速率,发生强酸制取弱酸的反应,可以通过控制加入酸的量,Ⅲ中发生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反应达到终点是S完全溶解;
(5)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3;
(6)加入盐酸,Na2S2O3反应生成S沉淀,所以静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
解答 解:(1)根据装置图可知仪器A的名称为圆底烧瓶,
故答案为:圆底烧瓶;
(2)检查该装置气密性的方法是:仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好,
故答案为:仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;
(3)D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:防止倒吸;NaOH;
(4)实验中为使SO2缓慢进入烧瓶C,需要控制滴加硫酸的速率,Ⅲ中发生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反应达到终点是S完全溶解,溶液变澄清,
故答案为:控制滴加硫酸的速率;溶液变澄清;
(5)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(6)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,可以利用总反应的分析,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 加入Al能放出大量H2的溶液中:Na+、HCO3-、NO3-、Cl-、SO42- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、SO32- | |
| C. | 常温时,由水电离的c(H+)=10-12mol•L-1的溶液中:Cl-、Fe2+、NO3-、NH4+、F- | |
| D. | 加入Mg能放出H2的溶液中:NH4+、Cl-、K+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖 | B. | 甲酸乙酯 | C. | 丁醛 | D. | 甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 草酸 | 碳酸 | |
| 一级电离常数(Kad) | 5.9×10-2 | 4.2×10-7 |
| 二级电离常数(Kad) | 6.4×10-3 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XCl | B. | XCl2 | C. | XCl3 | D. | XCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com