
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解 速率(×10-3 mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
| ||


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀的生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3?H2O |
| B、NaOH |
| C、NiO |
| D、CaCO3浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3的溶解度小于CaSO4 |
| B、沉淀转化的实质是沉淀溶解平衡的移动 |
| C、沉淀转化的难易与溶解度差别的大小无关 |
| D、CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
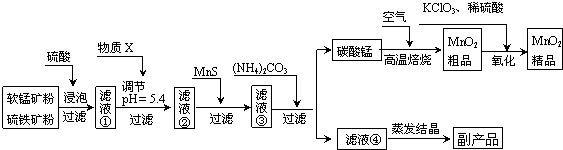
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com