
在温度和压强不变时,1LNO2高温分解(2NO2⇌2NO+O2),达到平衡时体积变为1.2L,这时NO2的转化率为( )
|
| A. | 40% | B. | 20% | C. | 60% | D. | 5% |
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”“小”).
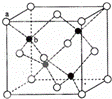
(2)TY2中心原子的杂化方式为 ;XY2中一个分子周围有 个紧邻分子;堆积方式与XY2晶胞类型相同的金属有 (从“Cu、Mg、K、Po”中选出正确的),其空间利用率为 .
(3)Z的第一电离能比Mg的 (填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 .
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是,原因是 .
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T.已知:
XO(g)+1/2O2(g)═XO2(g)△H=﹣283.0kJ•mol﹣1
T(s)+O2(g)═TO2(g)△H=﹣296.0kJ•mol﹣1
此反应的热化学方程式是 .
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方PT晶体结构如下图所示,其晶胞边长为540.0pm,密度为 g•cm﹣3(列式并计算).
查看答案和解析>>
科目:高中化学 来源: 题型:
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
|
| A. | 0.04 | B. | 0.04mol/(L•s) | C. | 0.08mol/(L•s) | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是( )
|
| A. | H2(g)+Cl2(g)=2HCl(g);△H=﹣184.6kJ/mol |
|
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=﹣802.3kJ/mol |
|
| C. | 2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJ/mol |
|
| D. | CO(g)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | PH小于7时一定为酸性 |
|
| B. | 水离子积Kw与 温度、酸碱性有关 |
|
| C. | c(H+)=c(OH﹣)的溶液一定为中性溶液 |
|
| D. | 加入酸或碱促进水电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)⇌2AB2(g)(正反应放热),下列说法正确的( )
|
| A. | 升高温度,正向反应速率减小,逆向反应速率增加 |
|
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
|
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
|
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯水加热至较高温度,下列叙述正确的是( )
|
| A. | 水的离子积变大、pH变小、呈酸性 |
|
| B. | 水的离了积不变、pH不变、呈中性 |
|
| C. | 水的离子积变小、pH变大、呈碱性 |
|
| D. | 水的离子积变大、pH变小、呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为NaHSO4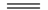 Na+ + H++
Na+ + H++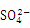 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
A.该温度高于25℃
B.水电离出来的c(H+)= 1×10-10 mol • L﹣1
C.c(H+)=c(OH-))+c(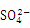 )
)
D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com