
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
 bcmol,质量为
bcmol,质量为  bcmol×64g/mol=160bcg,
bcmol×64g/mol=160bcg,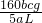 =
=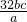 g/L.
g/L.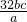 .
.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |

| 32bc |
| a |
| 32bc |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
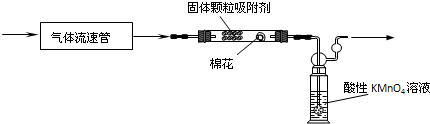
我国有许多燃煤电站,电站燃烧煤时产生了二氧化硫,为了减少二氧化硫的刺激,可在电站边建燃气脱硫工厂。工厂燃气脱硫工艺简图如图5-9所示。请根据以上材料,结合你所学的知识回答:

图5-9
(1)以上材料中,引起酸雨的人为因素是__________________。
(2)用化学方程式表示SO2形成酸雨的过程:__________________。
(3)酸雨不仅使土壤酸化,而且使土壤贫瘠,说明酸雨使土壤贫瘠的原因_________________。
(4)为减少电站在电能输送给远方时的能量损耗,采用何种输电方式比较合理?___________。
(5)脱硫工艺简图中,A是________,B是_______(填物质名称)。
(6)你认为应该如何控制酸雨污染物,防止酸雨危害?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
选项 | 城市 | 污染指数 | 首要污染物 | 空气级别 |
A | 北京 | 92 | TSP(总悬浮颗粒物) | Ⅱ |
B | 福州 | 42 | — | Ⅰ |
C | 珠海 | 22 | — | Ⅰ |
D | 重庆 | 98 | SO2 | Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)机动车所排放的废气中主要含CO及NOx,二者可造成光化学烟雾,NOx又是酸雨形成的重要帮凶,写出NO2与SO2反应的化学方程式:______________;为使摩托车尾气达标排放,可在排气筒中安装一催化净化装置,使尾气转化为无毒气体放出,写出化学反应方程式:____________________________________________________________________。
(2)某火力发电厂为除去有害气体SO2并变废为宝,采用燃气脱硫新工艺,如图1-6-9所示。写出燃气脱硫工艺中的化学反应方程式:________________;同时该工艺可副产__________。

图1-6-9
(3)SO2也是合成硫酸工厂排出的主要污染气体,通常用氨水来吸收,写出反应方程式______________;生成的盐既可作肥料,又可与浓硫酸反应生成SO2再用于合成硫酸,实现循环操作,该化学反应方程式为_________________________________________________。
(4)实验室中,一般用氢氧化钠溶液吸收尾气SO2,离子反应方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com