
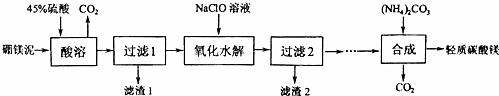
分析 由制备流程可知,硼镁泥的主要成分为MgCO3、SiO2,还有少量Fe2O3、MnO、CaO等,向废渣中加硫酸时SiO2不溶解,过滤得到滤渣1为二氧化硅,NaClO具有氧化性,能将Mn2+氧化为MnO2,调节PH生成MnO2、Fe(OH)3沉淀,过滤得滤渣2为MnO2、Fe(OH)3,再经过系列除杂后所得溶液中加碳酸铵溶液,得到轻质碳酸镁,
(1)MgCO3和硫酸反应生成硫酸镁和二氧化碳,硫酸过量可以使碳酸镁充分溶解;
(2)根据上面的分析可知滤渣2的主要成分,次氯酸钠能氧化锰离子生成MnO2,据此书写离子方程式;
(3)“合成”时在溶液中加碳酸铵溶液,得到轻质碳酸镁、硫酸铵和水,温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解,据此答题.
解答 解;由制备流程可知,硼镁泥的主要成分为MgCO3、SiO2,还有少量Fe2O3、MnO、CaO等,向废渣中加硫酸时SiO2不溶解,过滤得到滤渣1为二氧化硅,NaClO具有氧化性,能将Mn2+氧化为MnO2,调节PH生成MnO2、Fe(OH)3沉淀,过滤得滤渣2为MnO2、Fe(OH)3,再经过系列除杂后所得溶液中加碳酸铵溶液,得到轻质碳酸镁,
(1)MgCO3和硫酸反应生成硫酸镁和二氧化碳,反应方程式为MgCO3+H2SO4=MgSO4+CO2↑+H2O,硫酸过量可以使碳酸镁充分溶解生成硫酸镁,
故答案为:MgCO3+H2SO4=MgSO4+CO2↑+H2;使碳酸镁充分溶解生成硫酸镁;
(2)根据上面的分析可知滤渣2的主要成分为MnO2、Fe(OH)3,次氯酸钠能氧化锰离子生成MnO2,反应的离子方程式为Mn2++ClO-+H2O═MnO2↓+2H++Cl-,
故答案为:Fe(OH)3;Mn2++ClO-+H2O═MnO2↓+2H++Cl-;
(3)“合成”时在溶液中加碳酸铵溶液,得到轻质碳酸镁、硫酸铵和水,温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解,“合成”时反应的方程式为2MgSO4+2(NH4)2CO3+3H2O=MgCO3•Mg(OH)2•2H2O↓+2(NH4)2SO4++2CO3↑,
故答案为:温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解;2MgSO4+2(NH4)2CO3+3H2O=MgCO3•Mg(OH)2•2H2O↓+2(NH4)2SO4++2CO3↑.
点评 本题考查制备实验方案的设计,为高频考点,把握物质的制备的流程、理解反应原理为解答的关键,涉及物质的制备、除杂等知识,题目较为综合,有一定难度,本题注意要认真分析题中数据,考查学生的分析能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R气态氢化物化学式为H2R | |
| B. | R一定是Ⅵ族元素 | |
| C. | R的气态氢化物比同周期其他元素气态氢化物稳定 | |
| D. | R一定是第四周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
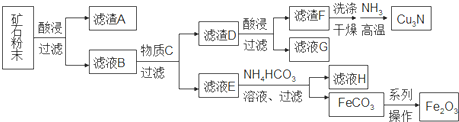
| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 酸性强弱:HIO4>HBrO4>HClO4 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定大于Y | B. | 第一电离能Y可能大于X | ||
| C. | 简单离子的半径:Xm->Yn- | D. | 气态氢化物的稳定性:HmX强于HnY |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 整个OC段反应过程中,反应速率逐渐增大 | |
| B. | BC段收集到的气体最多 | |
| C. | 因为OA段盐酸浓度最大,所以该段反应速率最快 | |
| D. | AB段反应快主要是因为反应放热导致的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com