
| »Æѧ¼ü | N”ŌN | F-F | N-F |
| ¼üÄÜ/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
| A£® | NF3·Ö×ÓµÄĮ¢Ģå¹¹ŠĶŹĒĘ½ĆęČż½ĒŠĪ | |
| B£® | ¹ż³ĢN£Øg£©+3F£Øg£©”śNF3£Øg£©·Å³öÄÜĮæ | |
| C£® | ·“Ó¦N2£Øg£©+3F2£Øg£©”ś2NF3£Øg£©µÄ”÷H£¾0 | |
| D£® | NF3³£ĪĀĻĀ³ŹĘųĢ¬£¬ŹĒŅņĪŖN-F¼üÄÜ“ó£¬ŗÜĪČ¶Ø |
·ÖĪö »Æѧ·“Ó¦ÖŠ¶ĻĮŃ»Æѧ¼üĪüŹÕÄÜĮ棬ŠĪ³É»Æѧ¼ü·Å³öÄÜĮ棬·“Ó¦ČȵČÓŚ·“Ó¦ĪļµÄ×ܼüÄܼõČ„Éś³ÉĪļµÄ×ܼüÄÜ£»ĪļÖŹŌŚ³£ĪĀĻĀדĢ¬Óė·Ö×Ó¼ä×÷ÓĆĮ¦ÓŠ¹Ų£¬Óė¹²¼Ū¼ü¼üÄÜ“óŠ”ĪŽ¹Ų£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗA£®NF3ÖŠ¼Ūµē×Ó¶ŌŹżĪŖ£ŗ$\frac{5+3}{3}$=4£¬ŠĪ³ÉĮĖĖÄĢõŌӻƹģµĄ£¬¼“NµÄŌÓ»ÆĄąŠĶĪŖsp3£¬ŠĪ³É3øö¹²ÓƵē×Ó¶Ō£¬»¹ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬Ņņ¶ųĪŖČż½Ē׶ŠĪ£¬¹ŹA“ķĪó£»
B£®N£Øg£©+3F£Øg£©”śNF3£Øg£©ĪŖŠĪ³É»Æѧ¼üµÄ¹ż³Ģ£¬·Å³öÄÜĮ棬¹ŹBÕżČ·£»
C£®·“Ó¦N2£Øg£©+3F2£Øg£©”ś2NF3£Øg£©”÷H=£Ø941.7+3”Į154.8-283.0”Į6£©KJ•mol-1=-291.9KJ•mol-1£¬”÷H£¼0£¬¹ŹC“ķĪó£»
D£®NF3³£ĪĀĻĀ³ŹĘųĢ¬£¬ĖµĆ÷Ęä·Šµć½ĻµĶ£¬¶ų·ŠµćÓė·Ö×Ó¼ä×÷ÓĆĮ¦ÓŠ¹Ų£¬ÓėN-F¼üµÄ¼üÄÜĪŽ¹Ų£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éę¼°·Ö×Ó¹¹ŠĶÅŠ¶Ļ”¢»Æѧ·“Ó¦ÓėÄÜĮæµÄ¼ĘĖćµČÖŖŹ¶£¬ĪŖøßæ¼øßĘµæ¼µć£¬ĢāÄæÄŃ¶Č²»“ó£¬ŹŌĢā²ąÖŲÓŚ·“Ó¦ČȵÄ漲飬עŅā»Æѧ¼üµÄ¼üÄÜÓė·“Ó¦ČČµÄ¹ŲĻµ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Mg£ØOH£©2£Ø Al£ØOH£©3£© | B£® | MgCl2£ØAlCl3£© | C£® | Mg£ØAl£© | D£® | MgO£ØAl2O3£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »Æѧ¼üÖ»“ęŌŚÓŚ·Ö×ÓÄŚ£¬·Ö×Ó¼ä×÷ÓĆĮ¦Ö»“ęŌŚÓŚ·Ö×Ó¼ä | |
| B£® | ·Ö×Ó¾§ĢåŌŚČŪ»ÆŹ±£¬¹²¼Ū¼üƻӊ±»ĘĘ»µ | |
| C£® | ŌŚ¾§ĢåĄļÓŠŃōĄė×Ó“ęŌŚŹ±£¬Ņ»¶ØÓŠŅõĄė×Ó“ęŌŚ | |
| D£® | ĪļÖŹŌŚČÜÓŚĖ®µÄ¹ż³ĢÖŠ£¬»Æѧ¼üŅ»¶Ø»į±»ĘĘ»µ»ņøıä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¶ĢÖÜĘŚŌŖĖŲa”¢b”¢c”¢dµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®ĖüĆĒ·ÖŹōÓŚ²»Ķ¬Ö÷×壬ÕāĖÄÖÖŌŖĖŲµÄŌ×Óµē×Ó²ćŹżÖ®ŗĶĪŖ8£®A”¢B”¢C”¢DŅĄ“ĪĪŖa”¢b”¢c”¢dµÄµ„ÖŹ£¬¼×”¢ŅŅ”¢±ū·Ö×ÓÄŚŌ×ÓŹżŅĄ“ĪĪŖ4”¢3”¢2£®ŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌ·¢ÉśČēĶ¼ĖłŹ¾µÄ»ÆŗĻ·“Ó¦£®
¶ĢÖÜĘŚŌŖĖŲa”¢b”¢c”¢dµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®ĖüĆĒ·ÖŹōÓŚ²»Ķ¬Ö÷×壬ÕāĖÄÖÖŌŖĖŲµÄŌ×Óµē×Ó²ćŹżÖ®ŗĶĪŖ8£®A”¢B”¢C”¢DŅĄ“ĪĪŖa”¢b”¢c”¢dµÄµ„ÖŹ£¬¼×”¢ŅŅ”¢±ū·Ö×ÓÄŚŌ×ÓŹżŅĄ“ĪĪŖ4”¢3”¢2£®ŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌ·¢ÉśČēĶ¼ĖłŹ¾µÄ»ÆŗĻ·“Ó¦£® £¬Čō½«¼×ĶØČėŅŅÖŠĖłµĆČÜŅŗPH“óÓŚ7£¬ÓĆ·½³ĢŹ½±ķŹ¾ČÜŅŗPH“óÓŚ7 µÄŌŅņ£ŗNH3•H2O?NH4++OH-£®
£¬Čō½«¼×ĶØČėŅŅÖŠĖłµĆČÜŅŗPH“óÓŚ7£¬ÓĆ·½³ĢŹ½±ķŹ¾ČÜŅŗPH“óÓŚ7 µÄŌŅņ£ŗNH3•H2O?NH4++OH-£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 4£¬4£¬3-¼×»łŅŃĶé | B£® | 2-¼×»ł-4ŅŅ»łĪģĶé | ||
| C£® | 2£¬2-¶ž¼×»łĪģĶé | D£® | 3-¼×»ł-2-ŅŅ»łøżĶé |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
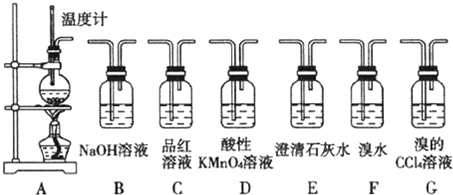
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
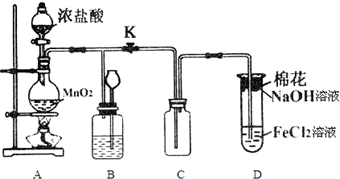
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com