
| A. | 常温下,正丁烷的燃烧热为-2878.0 kJ/mol | |
| B. | 相同质量的丙烷和丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 常温下,CO的燃烧热为566.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
分析 A、燃烧热是完全燃烧1mol物质生成稳定的产物所放出的热量;
B、根据燃烧的热化学方程式进行计算;
C、燃烧热是完全燃烧1mol物质生成稳定的产物所放出的热量;
D、人类利用的能源有太阳能、风能、光能、化学能等,据来源回答.
解答 解:A、根据正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2878.0kJ/mol知道,常温下正丁烷的燃烧热应为2878.0kJ/mol,故A错误;
B、丙烷燃烧时丙烷的质量、产生的热量以及消耗的氧气分别为44 g,2221.5kJ/mol,5 mol,正丁烷燃烧时正丁烷的质量、产生的热量以及消耗的氧气分别为58 g,2878.0 kJ/mol,6.5 mol,所以相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多,故B正确;
C、根据2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol知道:常温下,CO的燃烧热为283.0 kJ/mol,故C错误;
D、人类利用的能源可以不通过化学反应获得,如水力发电、风力发电、太阳能等,故D错误.
故选B.
点评 本题是一道关于化学反应中的能量变化的题目,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
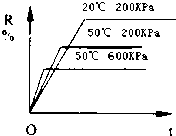 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2L(?),该反应中R的百分含量在不同条件下的变化如下图所示,请判断下列结论正确的是( )| A. | 正反应为放热反应,L为气体 | B. | 正反应为吸热反应,L为气体 | ||
| C. | 正反应为吸热反应,L为固体或液体 | D. | 正反应为放热反应,L为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
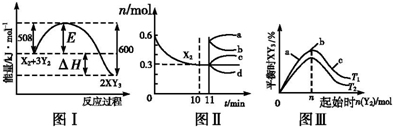
| A. | 由图Ⅰ可知,加入适当的催化剂,E和△H都减小 | |
| B. | 图Ⅱ中0~10 min内该反应的平均速率v(Y2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(X2)的变化曲线为d | |
| C. | 图Ⅲ中a、b、c三点所处的平衡状态中,反应物X2的转化率最高的是b点 | |
| D. | 图Ⅲ中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1<T2,K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
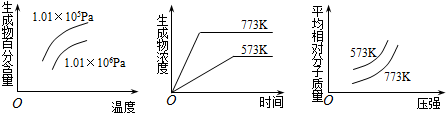
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g) (正反应为吸热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g) (正反应为放热反应) | |
| D. | 2HI(g)?I2(g)+H2(g) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 降低温度 | B. | 增大N的浓度 | C. | 减小X的浓度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物全部转化为甲醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | 反应体系中甲醇的百分含量不再变化 | |
| D. | CO和H2以1:1的物质的量之比反应生成甲醉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
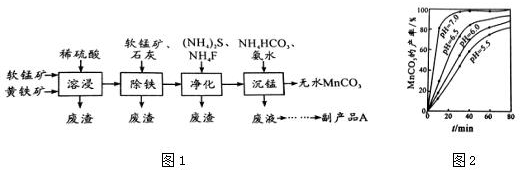
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com