
(16分)碳及其化合物有广泛的用途。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2) 已知:C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)  CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3) CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) =CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为_______________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4) 将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)  CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)________________________。
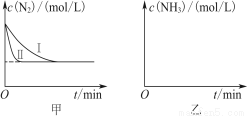
(5) 工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
请回答下列问题:①与实验Ⅰ比较,实验Ⅱ改变的条件为____________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
(1)A、D(2分); (2)-41.2 kJ/mol(2分);
(3)CH3OH(g)+H2O-6e-===CO2+6H+ (3分),14
(4)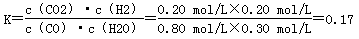 (2分)
(2分)
3CO2+5OH-===2CO32—+HCO3—+2H2O(3分)
(5)① 使用催化剂(2分)②(2分)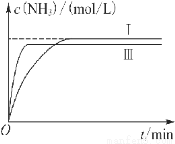
【解析】
试题分析:(1)该反应的正反应是气体体积增大的吸热反应。提高H2O的平衡转化率,就要使平衡正向移动。A.升高温度,根据平衡移动原理,平衡向吸热反应方向移动,即向正反应方向移动,H2O的平衡转化率提高,正确;B.由于碳是固体,所以增加碳的用量,平衡不发生移动,H2O的平衡转化率不变,错误; C.加入催化剂,能够缩短达到平衡所需要的时间,但是平衡不发生移动,因此H2O的平衡转化率不变,错误; D.用CO吸收剂除去CO,即减小生成物的浓度,平衡正向移动,H2O的平衡转化率增大,正确;(2)①C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,②C(s)+CO2(g)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,②C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,①-②整理可得CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,①-②整理可得CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ/mol;(3)在甲醇燃料电池中,通入甲醇的电极是负极,由于是用稀硫酸作电解质溶液,所以该电池负极反应式为CH3OH(g)+H2O-6e-=CO2+6H+;若有0.01 mol CH3OH完全放电,则电子转移0.06mol;由于在整个闭合回路中电子转移的数目相等,所以发生反应:2NaCl+2H2O
CO2(g)+H2(g) ΔH=-41.2 kJ/mol;(3)在甲醇燃料电池中,通入甲醇的电极是负极,由于是用稀硫酸作电解质溶液,所以该电池负极反应式为CH3OH(g)+H2O-6e-=CO2+6H+;若有0.01 mol CH3OH完全放电,则电子转移0.06mol;由于在整个闭合回路中电子转移的数目相等,所以发生反应:2NaCl+2H2O Cl2↑+H2↑+2NaOH 产生的NaOH的物质的量是0.06mol, 因为电解产生的Cl2全部逸出,所以电解后溶液中c(NaOH)=0.06mol÷0.06L=1mol/L,根据室温下水的离子积常数是1×10-14mol2/L2,可得c(H+)=Kw÷c(OH-)= 1×10-14÷1mol/L=1×10-14mol/L,所以pH=14;(4) CO(g)+H2O(g)
Cl2↑+H2↑+2NaOH 产生的NaOH的物质的量是0.06mol, 因为电解产生的Cl2全部逸出,所以电解后溶液中c(NaOH)=0.06mol÷0.06L=1mol/L,根据室温下水的离子积常数是1×10-14mol2/L2,可得c(H+)=Kw÷c(OH-)= 1×10-14÷1mol/L=1×10-14mol/L,所以pH=14;(4) CO(g)+H2O(g)  CO2(g)+H2(g)达到平衡时各种物质的物质的量浓度是:c(CO)=0.8mol/L;c(H2O)=0.3mol/L;c(CO2)=0.2mol/L;c(H2)= 0.2mol/L。K=
CO2(g)+H2(g)达到平衡时各种物质的物质的量浓度是:c(CO)=0.8mol/L;c(H2O)=0.3mol/L;c(CO2)=0.2mol/L;c(H2)= 0.2mol/L。K=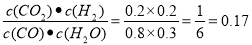 ;是n(CO2)=0.6mol;n(NaOH)=0.20L ×5 mol/L=1mol.则发生的反应是3CO2+5NaOH=2Na2CO3+NaHCO3。离子方程式是:3CO2+ 5OH-= 2CO32-+ HCO3-;(5)①由于与实验Ⅰ比较,实验Ⅱ达到平衡所需要的时间缩短,而物质的平衡含量不变,所以改变的条件为使用了催化剂;②实验Ⅲ比实验Ⅰ的温度要高,由于合成氨的反应是放热反应,若其他条件相同,升高温度,则化学反应速率加快,达到平衡所需要的时间缩短,但是化学平衡逆向移动,所以氨气的平衡含量降低,所以实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图是
;是n(CO2)=0.6mol;n(NaOH)=0.20L ×5 mol/L=1mol.则发生的反应是3CO2+5NaOH=2Na2CO3+NaHCO3。离子方程式是:3CO2+ 5OH-= 2CO32-+ HCO3-;(5)①由于与实验Ⅰ比较,实验Ⅱ达到平衡所需要的时间缩短,而物质的平衡含量不变,所以改变的条件为使用了催化剂;②实验Ⅲ比实验Ⅰ的温度要高,由于合成氨的反应是放热反应,若其他条件相同,升高温度,则化学反应速率加快,达到平衡所需要的时间缩短,但是化学平衡逆向移动,所以氨气的平衡含量降低,所以实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图是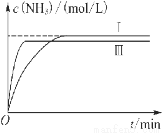 。
。
考点:考查外界条件对平衡移动的影响、化学平衡产生的计算、盖斯定律的应用、离子方程式的书写。


科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥ C.②⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是()
A.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后混合后,溶液的pH=7,则反应后的混合后,2c(R2-)+c(HR-)=c(Na+)
B.0.05mol/L的CH3COOH溶液中加入等体积的0.05mol/L的KOH溶液,则:c(CH3COOH)+c(H+)=c(OH-)
C.pH=5的CH3COOH溶液和pH=5NH4Cl溶液中c(H+)相等
D.0.2mol/L NH4Cl和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:填空题
(14分)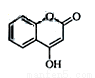 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
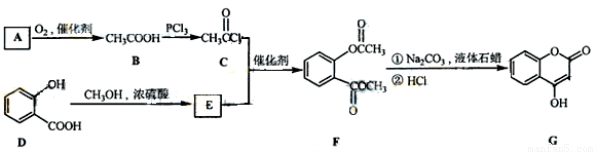
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式 。
(5)下列关于G的说法正确的是 。
a.能与溴单质反应 b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:实验题
(17分)利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。据此回答:
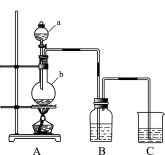
(1)C中的试剂是 ;仪器b的名称为 ,b中发生反应的离子方程式为 。
(2)写出新制饱和氯水中含有氯元素物质的化学式: 。氯水长时间放置,氯水中的成分就会发生变化,能快速判断氯水中含有较多C12的方法是: 。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字补充:
①氯水与NaOH反应,碱性减弱红色褪去。② 。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
【实验步骤】
①取上述实验后试管内的无色溶液3 mL盛于另一支洁净的试管中;② ,振荡试管。
【现象与结论】
①若 ,则证明溶液红色褪去的原因是①而不是②。
②若 ,则证明溶液红色褪去的原因是②而不是①。(5)为了从新制氯水中制得较高浓度的HClO,可向氯水中加入的试剂是 。
A.CaCO3 B.NaHSO3 C.Na2CO3 D.Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:选择题
下列有关物质分类正确的是
A.液氯、冰水混合均为纯净物
B.NO2、CO、CO2均为酸性氧化物
C.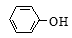 与
与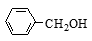 互为同系物
互为同系物
D.淀粉、纤维素和油脂都属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
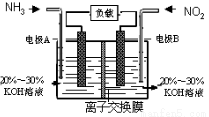
下列说法不正确的是
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为:2NH3-6e-=N2+6H+
D.当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com