
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
【答案】C
【解析】A. 可以看出来反应②为反应③提供了原料HI,故A正确;B. SO2在反应②中实现了再利用,故B正确;C.由已知化学方程式可知①+②+③可得系统(Ⅰ)制氢的热化学方程式为:H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,②+③+④可得系统(Ⅱ)制氢的热化学方程式为:H2S(g)
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,②+③+④可得系统(Ⅱ)制氢的热化学方程式为:H2S(g) ![]() H2(g) + S(g) ΔH = +20 kJ/mol;由上面的热化学方程式可知:制得等量H2所需能量较少的是系统(Ⅱ),故C错误;D. ①+②+③可得系统(Ⅰ)制氢的热化学方程式为:H2O(l)
H2(g) + S(g) ΔH = +20 kJ/mol;由上面的热化学方程式可知:制得等量H2所需能量较少的是系统(Ⅱ),故C错误;D. ①+②+③可得系统(Ⅰ)制氢的热化学方程式为:H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,故D正确;本题选C。
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol,故D正确;本题选C。


科目:高中化学 来源: 题型:
【题目】亚硝酰氯NOCl可用于合成清洁剂等。它可用Cl2与NO在常温常压下合成:它的熔点为-64.5℃,沸点为-5.5℃,常温下是黄色的有毒气体,遇水易水解。 请按要求回答下列相关问题:
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为:______________________。
(2)制备NOCl的装置如下图所示,连接顺序为:a→_________________________(按气流自左向右方向,用小写字母表示)。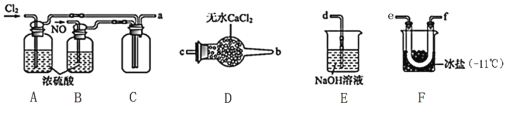
①装置A和B作用是①干燥NO和Cl2,②___________________________________________。
②装置D的作用是______________________________________。
③装置E中NOCl发生反应的化学方程式为________________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:
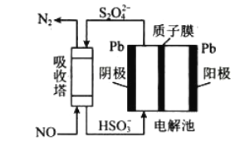
该过程中阴极的电极反应式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是
A. Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. FeS2![]() SO2
SO2![]() (NH4)2SO4
(NH4)2SO4
D. 饱和NaCl溶液![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:
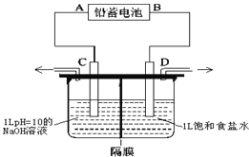
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极的电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知淀粉、葡萄糖及A、B、C、D、E之间的相互转化关系如下图所示请回答:

(1)B中的官能团名称是___________________A的电子式是_________________。
(2)已知C与D发生加成反应生成E,其化学方程式为_______________________。
(3)下列说法正确的是_____。
A.题中的“某工艺”指的是裂解
B.可用溴的四氯化碳溶液鉴别B和C
C.E不溶于水,能使酸性高锰酸钾溶液褪色
D.A在热Cu丝催化氧化下可生成相对分子质量比它小2的有机物
(4)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,______________。(实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:

(1)下列有关说法中正确的是_________。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“过滤1”可用倾析法,以缩减实验时间
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用_________的方式提高浸出率(写出3条)。
(3)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式__________________。
(4)由“滤渣3”制备铵明矾,经过如下步骤:a→g→_________→h(依次填入正确的序号)
a.加硫酸溶解 b.抽滤
c.加入蒸发皿中
d.降温结晶
e.蒸发至表面出现晶膜
f.配制饱和硫酸铵溶液
g.将硫酸铝溶液转移至蒸发皿
h.洗涤、干燥
(5)①根据各物质的溶解度曲线(见下图),在80℃时,用一定浓度的硫酸溶解“滤渣3”时,最适宜的硫酸浓度为_________。

A.3mol/L(1.20g/mL)
B.6mol/L(1.34g/mL)
C.9mol/L(1.49 g/mL)
D.18mol/L (1.84g/mL)
②所需硫酸用量的简便确定方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列过程的化学用语表述正确的是
A. 用硫酸铜溶液除去乙炔中的硫化氢气体:H2S + Cu2+=== CuS↓ + 2H+
B. 向氯化铝溶液中滴入过量氨水:Al3+ + 4OH- === AlO2- + 2H2O
C. 用电子式表示Na和Cl形成NaCl的过程:![]()
D. 钢铁发生电化学腐蚀的正极反应:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行以下可逆反应:M(g)+N(g)![]() P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )
P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )
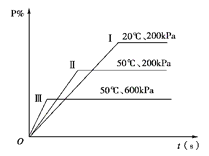
A. 正反应放热,L是固体
B. 正反应放热,L是气体
C. 正反应吸热,L是气体
D. 正反应放热,L是固体或气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示该温度下BaSO4的溶度积常数,则平衡后的溶液中
A. c(Ba2+)=c(SO42-)=![]() B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C. c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) D. c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com