
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22-![]() Sn(OH)2
Sn(OH)2![]() Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______;此锡粉样品中锡的质量分数________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
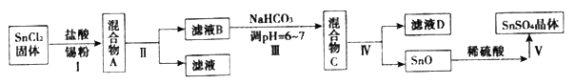
① 步骤I加入Sn粉的作用:___________及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________。
【答案】 50 将Sn2+氧化为Sn4+ 60% 防止Sn2+氧化为Sn4+ Sn2++2HCO3-=SnO↓+2CO2↑+H2O Sn2++2e-=Sn 镀锡铁破损后在潮湿的环境中容易形成原电池,促进铁的腐蚀 O2+4e-+2H2O=4OH- SnCl4+4H2O=Sn(OH)4+4HCl SnO2 氨水
【解析】(1)碳为第二周期ⅣA元素,则元素锡比同主族碳的周期数大3,为第五周期ⅣA元素,已知第五周期0族氙元素的核电荷数为54,则锡的原子序数为54-4=50;
(2)Fe2(SO4)3将Sn2+全部氧化为Sn4+,再用溶液K2Cr2O7溶液滴定,将Fe2+氧化为Fe3+;
设粉中锡的质量分数为x,则:
3Sn~3Sn2+~6Fe3+~6Fe2+~K2Cr2O7
3×119g 1mol
1.19g×x 0.100mol/L×0.02L
故3×119g:1.19g×x=1mol:0.100mol/L×0.02L
解得x=60%;
(3)① 由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化; ②得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,变质发生水解反应生成Sn(OH)2与二氧化碳,Sn(OH)2再脱水得到SnO,反应离子方程为:Sn2++2HCO3-=SnO↓+2CO2↑+H2O ;
③在铁片上镀锡,则阴极上发生还原反应,有锡析出,其电极反应式是Sn2++2e-=Sn;镀锡铁破损后在潮湿的环境中容易形成原电池,铁比锡活泼,铁为负极,促进铁了腐蚀;若是在较弱的酸性环境中发生腐蚀,正极发生还原反应,其电极反应式是O2+4e-+2H2O=4OH-;
(4)SnCl4水解得到Sn(OH)4与HCl,HCl与氨气反应得到NH4Cl,反应方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
(5)①加热SnCl4溶液时,SnCl4水解生成HCl,HCl易挥发促进SnCl4水解,然后灼烧最终得到金属氧化物SnO2;
②根据2H++SnO22-Sn(OH)2Sn2++2OH-知,Sn(OH)2具有两性,能溶于强碱、强酸,所以用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用弱碱NH3H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,正确的是
①SiO2可用来制造半导体材料 ②Si可用于制造光导纤维
③Al(OH)3可用于治疗胃酸过多 ④SiO2、Na2CO3和CaCO3可用于制玻璃
A. ①③ B. ③④ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列8种物质:①Fe ②H2O ③H2SO4 ④Cu(OH)2 ⑤(CuSO4·5H2O)⑥酒精⑦乙醇(CH3CH2OH) ⑧NaHCO3
(1)属于混合物的是__________(填序号,下同),属于单质的是__________,属于氧化物的是__________,属于酸的是__________,属于盐的是___________,属于碱的是________,属于有机物的是____________。
(2)写出下列指定物质在一定条件下反应的化学方程式,是氧化还原反应的,指出氧化剂和还原剂(不是氧化还原反应的,该空填写“无”)。
①与②_________________氧化剂______________还原剂_____________
(3)写出下列指定物质在溶液中反应的离子方程式
③与⑧_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是( )
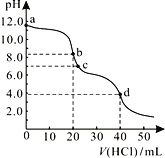
A. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
B. a点溶液呈碱性的原因用离子方程式表示为: CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. b点溶液中c(Na+)> c(HCO![]() )> c(Cl-)
)> c(Cl-)
D. d点处溶液中水的电离程度大于b点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A. 反应中MnO2是氧化剂 B. 该反应属于复分解反应
C. KClO3在反应中失去电子 D. 反应中每生成lmol K2MnO4,氧化剂得到2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四瓶溶液区分开,这种试剂是( )
A. NaOH溶液 B. AgNO3溶液
C. BaCl2溶液 D. Ba(OH)2浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(2)根据等电子原理,写出CO分子的结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是 ;
甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;
1mol甲醛分子中σ键的数目为 。
③在1个Cu2O 晶胞中(结构如图所示),

所包含的Cu 原子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2min 后,测得参加反应的X2为0.6mol/L,用Y2的变化表示的反应速率v(Y2) =0.1mol/(L·min),生成的c(Z)为0.4mol/L,则该反应的化学方程式是
A. X2+2Y2 ![]() 2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2![]() 2X2Y
2X2Y
C. 3X2+Y2![]() 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.8g FeS与400mL 1 mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3, X、H2O,则X为
A. N2 B. N2O C. NO D. NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com