
25 ℃时,浓度均为0.2 mol·L-1的NaHCO3与Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡 B.存在的粒子种类相同
C.c(H+)前者小于后者 D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
C
【解析】
试题分析:A.都存在着水的电离平衡和HCO3-及CO32-的水解平衡。正确。B.在这两种溶液中都存在着Na+、H+、HCO3-、CO32-、OH-、H2CO3、H2O。种类相同。正确。C.
HCO3-+ H2O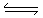 H2CO3+
OH-; HCO3-、CO32-+H2O
H2CO3+
OH-; HCO3-、CO32-+H2O
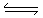 H2CO3-+OH-.水解程度后者大于前者,所以溶液中C(OH-)浓度CO32-大于HCO3-。因为在溶液中C(H+)·C(OH-)=Kw, C(OH-)越大,C(H+)的浓度就越小。故c(H+) 后者小于前者。错误但符合题意。D.加入NaOH固体,水解平衡CO32-+H2O
H2CO3-+OH-.水解程度后者大于前者,所以溶液中C(OH-)浓度CO32-大于HCO3-。因为在溶液中C(H+)·C(OH-)=Kw, C(OH-)越大,C(H+)的浓度就越小。故c(H+) 后者小于前者。错误但符合题意。D.加入NaOH固体,水解平衡CO32-+H2O 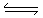 H2CO3-+OH-.逆向移动,c(CO32-)增大。NaHCO3溶液中发生反应NaHCO3+NaOH=
Na2CO3+ H2O。c(CO32-)增大。因此c(CO32-)均增大,正确但不符合题意。
H2CO3-+OH-.逆向移动,c(CO32-)增大。NaHCO3溶液中发生反应NaHCO3+NaOH=
Na2CO3+ H2O。c(CO32-)增大。因此c(CO32-)均增大,正确但不符合题意。
考点:考查NaHCO3与Na2CO3的化学性质。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温、高压 | 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com