


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| 选项 | Ⅰ | Ⅱ |
| A | 向Ca(OH)2 溶液中加入足量NaHCO3溶液 | 向NaHCO3溶液中加入足量Ca(OH)2溶液 |
| B | 向NH3?H2O溶液加入过量AlCl3溶液 | 向AlCl3溶液加入过量NH3?H2O溶液 |
| C | 将少量HCl溶液滴入Na2CO3溶液中 | 将少量Na2CO3溶液滴入过量HCl溶液中 |
| D | 将少量氯气通入过量FeBr2溶液中 | 将过量氯气通入少量FeBr2溶液中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2 |
| B、H2SO4 |
| C、Na2SO4 |
| D、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如图所示.
用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯、乙烷 |
| B、丙炔、丙烯 |
| C、丙烯、丁烷 |
| D、甲醛、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 1 mol/L的盐酸溶液中,含HCl分子数为nA |
| B、0.1 mol Na2O2与水完全反应,转移0.2nA个电子 |
| C、标准状况下,22.4 L氩气含有原子数为2nA |
| D、常温常压下,32g O2、O3的混合物含有2nA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
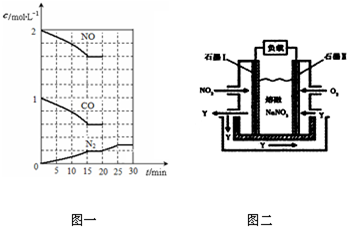
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com