
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
【知识点】离子共存问题;盐类水解的应用 B4 H3 H6
【答案解析】(1) Ba(OH)2
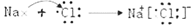
(2) c(HCO3﹣)>c(Ba2+)>c(OH﹣)>c(H+)>c(CO32﹣)
(3) Ba2++CO32﹣+2NH4++2OH﹣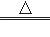 2NH3↑+2H2O+BaCO3↓
2NH3↑+2H2O+BaCO3↓
(4) NH4+的水解程度小于CO32﹣的水解程度
解析:根据A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,气体为氨气,再由A、D溶液呈碱性,B呈酸性,C呈中性,A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,则A为Ba(OH)2,B为强酸弱碱盐,则B为Al2(SO4)2,C为强酸强碱盐,则C为NaCl,D为弱酸弱碱盐,则D为(NH4)2CO3。
(1)A为Ba(OH)2;C为NaCl,其形成过程为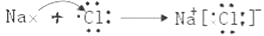 ;
;
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,溶液的溶质为Ba(HCO3)2,由化学式及电离可知c(HCO3-)>c(Ba2+),再由水解显碱性可知c(OH-)>c(H+),电离产生极少的CO32-,即离子物质的量浓度由大到小的顺序为c(HCO3-)>c(Ba2+)>c(OH-)>c(H+)>c(CO32-);
(3)③为Ba(OH)2与(NH4)2CO3的反应,其离子反应为Ba2++CO32-+2NH4++2OH- 2NH3↑+2H2O+BaCO3↓,
2NH3↑+2H2O+BaCO3↓,
(4)(NH4)2CO3溶液显碱性,是因NH4+的水解程度小于CO32-的水解程度。
【思路点拨】本题考查了物质的推断、离子的共存、离子浓度大小的比较、水解、离子反应等知识,综合性较强,难度较大,需要学生在推断时综合考虑信息的利用,对学生能力要求较高。


科目:高中化学 来源: 题型:
进行下面的实验要用到下列一种或几种仪器,请用这些仪器的名称填空。
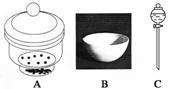
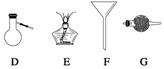
(1)欲干燥NH3需使用仪器________________________________________________;
(2)欲分离互不相溶的两种液体,可使用____________________________________;
(3)欲分离液态混合物中沸点不同的组分,可使用_____________________________;
(4)欲分离悬浮于液体中的固体物质,可使用_________________________________;
(5)欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共0.5mol,完全燃烧时放出热量723.2kJ,则混合气体中氢气和丙烷的体积比约为
A. 1:3 B.2:3 C.3:2 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
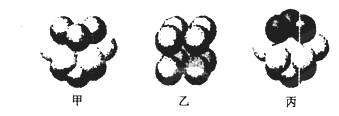
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组顺序排列正确的是
A.密度:Na > K > Li B.热稳定性:HCl > H2S > H2O
C.酸性:H2CO3 < H2SiO3 < HNO3 D.离子半径:F -> A13+ > CI –
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是( )

A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气资源的说法正确的是 ( )
A.石油裂解得到的汽油是纯净物 B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料 D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com