
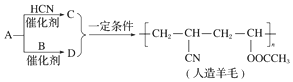
| A. | A生成D的反应属于取代反应 | B. | A生成C的反应属于加成反应 | ||
| C. | 合成人造羊毛的反应属于加聚反应 | D. | 烃A的结构简式为CH≡CH |
分析 由以烃A为原料生产人造羊毛的合成路线可知,人造羊毛为加聚反应产物,A与HCN反应生成C,则C为CH2=CHCN,D为CH2=CHOOCCH3,A为CH≡CH,A与B反应生成D,可知B为CH3COOH,以此来解答.
解答 解:A.A为CH≡CH,B为CH3COOH,二者发生加成反应生成D为CH2=CHOOCCH3,故A错误;
B.A为CH≡CH,C为CH2=CHCN,A与HCN发生加成反应生成C,故B正确;
C.C、D中均含碳碳双键,人造羊毛中主链只含C,则合成反应为加聚反应,故C正确;
D.由上述分析可知,A为乙炔,结构简式为CH≡CH,故D正确;
故选A.
点评 本题考查有机物的合成,为高频考点,把握逆反应法应用、高分子的合成方法为解答的关键,侧重分析与应用能力的考查,注意A与B的反应类型为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 实验室中配制FeCl3溶液时,向其中加入少量稀盐酸 | |
| B. | 钢铁在潮湿的环境下易生锈 | |
| C. | Mg(OH)2沉淀可溶解于NH4Cl溶液中 | |
| D. | 热的纯碱溶液去油污效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 测定常温时的饱和HCOONa溶液、CH3COONa溶液的pH | HCOONa的pH<CH3COONa的pH | 弱酸的酸性:HCOOH>CH3COOH |
| B | 向5ml 2mol•L-1NaOH溶液中加入1ml 1mol•L-1CuSO4溶液,振荡后加入0.5ml有机物X,加热 | 未出现砖红色沉淀 | 说明X中不含有醛基 |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
| D | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氧化铝沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
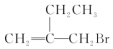
| A. | 该物质可以发生水解反应 | |
| B. | 该物质能和AgNO3溶液反应产生AgBr沉淀 | |
| C. | 该物质可以发生消去反应 | |
| D. | 该物质不能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | X | Y |
| Z | W |
| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | R、X、Y、Z、W各元素最高价和最低价的绝对值之和均为8 | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、W | |
| D. | RY3、W2X、ZW5分子中每个原子最外层都达到8 电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①、③的操作分别是过滤、萃取 | |
| B. | 步骤②的反应是非氧化还原反应 | |
| C. | 步骤③中加入的有机溶剂是裂化汽油或四氯化碳 | |
| D. | 步骤④的操作是过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方 案 |  |  | 向蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热 |  |
| 目 的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 检验蔗糖水解产物中是否含有葡萄糖 | 比较Cl2、I2的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com