
| A. | 反应后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| C. | 反应后产生13.44L H2(标准状况) | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
分析 Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3-═Fe3++NO↑+2H2O、再发生Fe+2Fe3+═3Fe2+,若还有Fe剩余,则最后发生Fe与氢离子的反应,以此来解答.
解答 解:Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,则
Fe+4H++NO3-═Fe3++NO↑+2H2O
1 4 1 1
0.6 2.4 0.6 0.6
Fe+2Fe3+═3Fe2+,
1 2 3
0.1 0.2 0.3
Fe完全反应,没有剩余,溶液中存在0.6molFe3+、0.3molFe2+、
A.反应后溶液中H+剩余1.5mol×2-2.4mol=0.6mol,故A错误;
B.氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3-═Fe3++NO↑+2H2O,有气体生成,故B错误;
C.不发生Fe+2H+═Fe2++H2↑,没有氢气生成,故C错误;
D.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故D正确;
故选D.
点评 本题考查铁的化学性质及化学反应的计算,明确发生的化学反应及反应的先后是解答本题的关键,注意过量计算来解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=3的HNO3与pH=11的KOH溶液 | |
| B. | pH=3的HNO3与pH=11的氨水 | |
| C. | pH=3的H2SO4与pH=11的NaOH | |
| D. | pH=3的CH3COOH 与pH=11的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
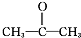 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
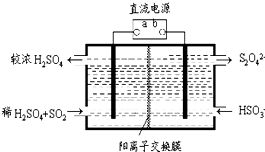 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
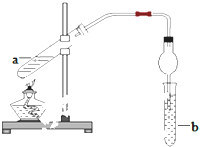 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的空间构形 |
| SO3 | 0 | sp2杂化 | 平面三角形 |
| PO43- | 0 | sp3杂化 | 正四面体 |
| NCl3 | 1 | sp3杂化 | 三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com